题目内容
18.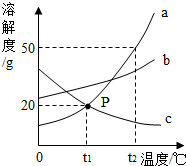 请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:(1)P点的含义是t1℃时,a和c的溶解度相等.
(2)将t2°C时的a、b、c三种物质的饱和溶液降温到t1°C时,溶液中溶质的质量分数由大到小的顺序是b>a>c.
(3)适合采取冷却热饱和溶液析出晶体的是a.
(4)你还能获得哪些信息(只写一条)a和b的溶解度随着温度的升高而增大.
分析 溶解度曲线的交点表示该温度下,两种物质的溶解度相等;
饱和溶液的溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%;
从溶液中结晶的方法有两种:蒸发结晶和降温结晶,物质的溶解度受温度变化影响较小时,应该用蒸发结晶;物质的溶解度受温度变化影响较大时,应该用降温结晶;
根据物质的溶解度曲线可以判断相关方面的问题.
解答 解:(1)P点的含义是:t1℃时,a和c的溶解度相等.
故填:t1℃时,a和c的溶解度相等.
(2)将t2℃时的a、b、c三种物质的饱和溶液降温到t1℃时,因为t1℃时b的溶解度大于a的溶解度,因此b的质量分数大于a的质量分数,因为a在t1℃时的溶解度大于c在t2℃时的溶解度,因此a的质量分数大于c的质量分数,溶液中溶质的质量分数由大到小的顺序是b>a>c.
故填:b>a>c.
(3)a的溶解度受温度变化影响较大,适合采取冷却热饱和溶液析出晶体.
故填:a.
(4)由溶解度曲线可知,a和b的溶解度随着温度的升高而增大,c的溶解度随着温度的升高而减小.
故填:a和b的溶解度随着温度的升高而增大.
点评 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列归纳总结中,正确的是( )
| A. | CO2、SO2、H2O2三种物质中,都含有氧气 | |
| B. | Na、Na+具有相同的质子数,都属于同种元素 | |
| C. | NaOH、Ca(OH)2都是常见的碱,都可用于改良酸性土壤 | |
| D. | 不用任何试剂,都能用闻气味的方法检验某盐中是否含有NH4+ |
9.此表列出了除去物质中所含少量杂质的方法,合理的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | 炭粉 | Cu粉 | 通入过量氧气,加热 |
| B | CO2气体 | CO | 通入过量氢氧化钠溶液 |
| C | NaCl | CaCO3 | 加入过量水溶解、过滤后取滤液,蒸发 |
| D | MgCl2溶液 | CuCl2 | 加入过量NaOH溶液,充分反应后过滤,得到滤液 |
| A. | A | B. | B | C. | C | D. | D |
6.下列说法正确的是( )
| A. | 中和反应生成盐和水,生成盐和水的反应一定是中和反应 | |
| B. | 侯德榜制碱法,制出的火碱又叫烧碱 | |
| C. | 花香四溢,说明分子在不断地运动 | |
| D. | 铝比铁的抗锈蚀性能强,说明铝的金属活动性比铁弱 |
13.20℃NaCl的溶解度是36g,把40g的NaCl加入到20℃的100g水中,充分搅拌,所得溶液中溶质的质量分数是( )
| A. | 36% | B. | 40% | C. | 28.6% | D. | 26.5% |
3.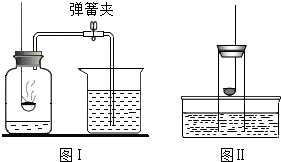 下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )
下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )
 下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )
下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )| A. | 不能用木炭代替红磷 | |
| B. | 图II所示装置也可以测定空气中氧气含量 | |
| C. | 图I中进入集气瓶的水约占烧杯中水的五分之一 | |
| D. | 氮气不与红磷反应且难溶于水,是设计该实验的依据之一 |
10.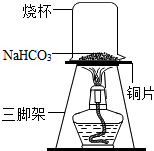 糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.
糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.
【探究实验一】碳酸氢钠溶液的酸碱性:用pH试纸测得碳酸氢钠溶液的pH约为9,由此得出结论是碳酸氢钠溶液呈碱性.
【探究实验二】碳酸氢钠的热稳定性:取一定量碳酸氢钠放在铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,振荡,观察到石灰水变浑浊.
(3)通过进一步实验来确定充分加热后的固体产物的成分.限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管
(4)根据上述实验结论,写出碳酸氢钠受热分解的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O..
 糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.
糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.【探究实验一】碳酸氢钠溶液的酸碱性:用pH试纸测得碳酸氢钠溶液的pH约为9,由此得出结论是碳酸氢钠溶液呈碱性.
【探究实验二】碳酸氢钠的热稳定性:取一定量碳酸氢钠放在铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,振荡,观察到石灰水变浑浊.
(3)通过进一步实验来确定充分加热后的固体产物的成分.限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,滴加足量氯化钙溶液,振荡,静置 | 产生白色沉淀 | 产物含Na2CO3 |
| ② | 取操作①后的上层清液于试管B中,滴加酚酞溶液 | 溶液不变色 | 产物不含NaOH |
7.据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与
小组同学共同完成以下探究:
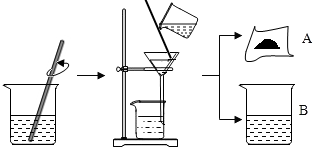
【提出问题1】固体A中的成分是什么?
【查阅资料】
①CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
②碳酸钾与碳酸钠性质相似,在溶液中都能与氢氧化钙发生复分解反应.
【猜想与假设】甲同学:只有CaCO3 乙同学:CaCO3、Ca(OH)2 丙同学:CaCO3、CaO
甲、乙两位同学认为丙同学的猜想不合理,理由是CaO+H2O=Ca(OH)2(用化学方程式表示).
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了下述实验:
【反思与评价】小组同学讨论后认为,甲同学的实验不能证明他的猜想,理由是CaCO3和Ca(OH)2混合物加入盐酸也会有气体产生,所以不能证明固体中只有CaCO3;而乙同学的实验能证明他的猜想,因此小组同学确定了固体A的成分.
【提出问题2】溶液B中溶质的成分是什么?
【猜想与假设】猜想1:KOH、K2CO3 猜想2:KOH、Ca(OH)2 猜想3:KOH
【表达与交流】结合上述实验,同学们讨论确定了猜想2正确,理由是反应后一定有KOH生成,上述实验中乙同学证明了固体含有Ca(OH)2,则溶液中一定存在溶解的Ca(OH)2.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为Ca(OH)2+K2CO3═CaCO3↓+2KOH.
小组同学共同完成以下探究:

【提出问题1】固体A中的成分是什么?
【查阅资料】
①CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
②碳酸钾与碳酸钠性质相似,在溶液中都能与氢氧化钙发生复分解反应.
【猜想与假设】甲同学:只有CaCO3 乙同学:CaCO3、Ca(OH)2 丙同学:CaCO3、CaO
甲、乙两位同学认为丙同学的猜想不合理,理由是CaO+H2O=Ca(OH)2(用化学方程式表示).
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了下述实验:
| 实验内容 | 实验现象 | 实验结论 |
| 甲同学:取少量固体于试管中,向其中加入稀盐酸. | 有气泡产生 | 自己的猜想正确 |
| 乙同学:取少量固体于试管中,加水溶解后过滤,向滤液中加入酚酞溶液 | 滤液变为红色 | 自己的猜想正确 |
【提出问题2】溶液B中溶质的成分是什么?
【猜想与假设】猜想1:KOH、K2CO3 猜想2:KOH、Ca(OH)2 猜想3:KOH
【表达与交流】结合上述实验,同学们讨论确定了猜想2正确,理由是反应后一定有KOH生成,上述实验中乙同学证明了固体含有Ca(OH)2,则溶液中一定存在溶解的Ca(OH)2.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为Ca(OH)2+K2CO3═CaCO3↓+2KOH.
8.下列各组转化中,一定条件下均能一步实现的组合是( )


| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |