题目内容
为测定鸡蛋壳中碳酸钙的质量,某同学将鸡蛋壳洗净、晾干、粉碎后,取样品10克,与足量的稀盐酸充分反应(杂质不与盐酸反应),产生二氧化碳2.64克,计算鸡蛋壳中碳酸钙的质量分数.
分析:由生成二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出鸡蛋壳中碳酸钙的质量分数.
解答:解:设鸡蛋壳中碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.64g
=
解得:x=6g
所以碳酸钙的质量分数为:
×100%=60%
答:鸡蛋壳中碳酸钙的质量分数为60%.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.64g
| 100 |
| x |
| 44 |
| 2.64g |
解得:x=6g
所以碳酸钙的质量分数为:
| 6g |
| 10g |
答:鸡蛋壳中碳酸钙的质量分数为60%.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,然后,根据所给的问题情景结合所学的相关知识和技能,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
 (2010?松江区一模)小张同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下实验探究.
(2010?松江区一模)小张同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下实验探究.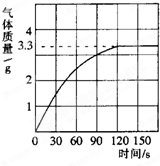 某校化学兴趣小组同学为了测定鸡蛋壳中碳酸钙的含量,将一定质量分数的稀盐酸逐滴加入到10.0g干燥的碎鸡蛋壳中,产生CO2气体的情况如图所示.当恰好完全反应时,消耗稀盐酸30.0g.求:
某校化学兴趣小组同学为了测定鸡蛋壳中碳酸钙的含量,将一定质量分数的稀盐酸逐滴加入到10.0g干燥的碎鸡蛋壳中,产生CO2气体的情况如图所示.当恰好完全反应时,消耗稀盐酸30.0g.求: 鸡蛋壳的主要成分是碳酸钙,为测定鸡蛋壳中的碳酸钙含量,某同学将鸡蛋壳洗净、充分干燥并捣碎,展开了下列探究.
鸡蛋壳的主要成分是碳酸钙,为测定鸡蛋壳中的碳酸钙含量,某同学将鸡蛋壳洗净、充分干燥并捣碎,展开了下列探究.