题目内容
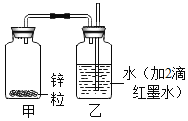
【题目】小金以10克锌、8克氧化铜和足量的稀硫酸为原料制取单质铜,实验装置如图所示。下列有关分析正确的是( )
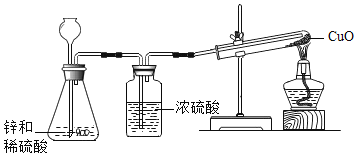
A.实验中,可观察到试管内红色粉末变黑
B.实验中,当6.5克锌反应时可以得到6.4克铜
C.实验时,应该先点酒精灯,再往漏斗里倒入稀硫酸
D.实验时,应该小流量连续缓慢地把稀硫酸加入锥形瓶中
【答案】D
【解析】
A.在加热的条件下,氢气与氧化铜反应生成铜和水,所以试管中观察到黑色粉末变化成了红色,故错误;
B.设生成6.4g铜需要锌的质量为x,则由化学方程式Zn+H2SO4=ZnSO4+H2↑、H2+CuO![]() Cu+H2O可知:
Cu+H2O可知:  ,
,![]() ,解得x=6.5g;
,解得x=6.5g;
但是,在实际实验中需要先通入一会儿氢气,实验结束后还要继续通入氢气直到试管冷却,所以实际所需锌的质量大于6.5g,故错误;
C.实验中,应先往漏斗里倒入稀硫酸,将生成的氢气通入试管排净其中的空气,然后再点燃酒精灯加热,故错误;
D.实验时,应该小流量连续缓慢地把稀硫酸加入锥形瓶中,使其匀速、持续产生氢气,故正确。
故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目