题目内容
对比学习有利于发现事物的共性与个性.为探究酸的性质,同学们进行了如下实验.| 实验内容 | 实验现象 | 分析与结论 |
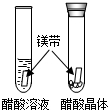
 | A试管内______,B试管中镁带表面冒气泡. | 酸的很多反应通常在水溶液中才能完成. |
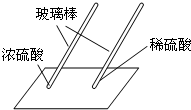
 | ______(填“浓”或“稀”)盐酸瓶口的蓝色石蕊试纸很快变红. | 即使是同种酸,由于 ______不同,它们的性质不完全相同. |
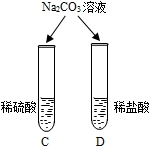
 | 两试管中均产生______ | 不同的酸具有相似的性质,这是因为酸的组成中都含有______(填元素符号). |
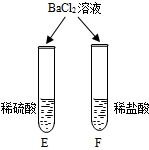
 | E试管中产生______, F试管中无明显现象. | 不同的酸根会导致酸的“个性”差异.因此,可用氯化钡溶液鉴别盐酸和硫酸. |
Ⅰ.废液缸中产生气体的反应的化学方程式为______.
Ⅱ.废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有______(填化学式).
【答案】分析:碳酸钠和盐酸反应生成氯化钠、水以及二氧化碳.
解答:解:酸的很多反应通常在水溶液中才能完成,因此A试管内无明显现象,B试管中镁带表面冒气泡;
浓盐酸瓶口的蓝色石蕊试纸很快变红,说明即使是同种酸,由于溶质质量分数不同,它们的性质不完全相同;
两试管中均产生气泡,说明不同的酸因为组成中都含有氢离子而具有相似的性质;
E试管中氯化钡和稀硫酸反应产生白色沉淀,F试管中盐酸和氯化钡不反应,无明显现象,说明不同的酸根会导致酸的“个性”差异;
故答案为:
Ⅰ、废液缸中立刻冒气泡,说明C中碳酸钠过量,CF试管中的液体混合后,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,
故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑.
Ⅱ、C中试管中碳酸钠和硫酸反应生成硫酸钠,废液缸里除了硫酸钠和氯化钡反应产生的白色沉淀外,若过量的碳酸钠和稀盐酸反应后还有剩余,那么碳酸钠还会和氯化钡反应生成碳酸钡沉淀;
故答案为:BaCO3.
点评:本题主要考查了酸和碱的性质,只有根据题中的信息结合已学知识认真分析,难度不大.
解答:解:酸的很多反应通常在水溶液中才能完成,因此A试管内无明显现象,B试管中镁带表面冒气泡;
浓盐酸瓶口的蓝色石蕊试纸很快变红,说明即使是同种酸,由于溶质质量分数不同,它们的性质不完全相同;
两试管中均产生气泡,说明不同的酸因为组成中都含有氢离子而具有相似的性质;
E试管中氯化钡和稀硫酸反应产生白色沉淀,F试管中盐酸和氯化钡不反应,无明显现象,说明不同的酸根会导致酸的“个性”差异;
故答案为:
| 无明显现象 | ||
| 浓 | 溶质质量分数 | |
| 气泡 | H+ | |
| 白色沉淀 |
故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑.
Ⅱ、C中试管中碳酸钠和硫酸反应生成硫酸钠,废液缸里除了硫酸钠和氯化钡反应产生的白色沉淀外,若过量的碳酸钠和稀盐酸反应后还有剩余,那么碳酸钠还会和氯化钡反应生成碳酸钡沉淀;
故答案为:BaCO3.
点评:本题主要考查了酸和碱的性质,只有根据题中的信息结合已学知识认真分析,难度不大.

练习册系列答案
相关题目
对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
| 实验内容 | 实验现象 | 分析与结论 |
 | 醋酸晶体试管内 (1),醋酸溶液试管中镁带表面冒气泡。 | 酸的很多反应通常在水溶液中才能完成。 |
用玻璃棒蘸硫酸在白纸上写字 | (2)(填“浓”或“稀”)硫酸使白纸炭化。 | 即使是同种酸,由于(3) 不同,它们的性质不完全相同。 |
 | 两试管中均产生(4) | 不同的酸具有相似的性质,这是因为酸的组成中都含有 (5)(填元素符号)。 |
 | E试管中产生 (6) , F试管中无明显现象。 | 不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
Ⅰ.废液缸中产生气体的化学方程式为 (7) 。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有 (8) (填化学式)。
对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
| 实验内容 | 实验现象 | 分析与结论 |
|
| 醋酸晶体试管内 ▲(1),醋酸溶液试管中镁带表面冒气泡。 | 酸的很多反应通常在水溶液中才能完成。 |
| 用玻璃棒蘸硫酸在白纸上写字 | ▲(2)(填“浓”或“稀”)硫酸使白纸炭化。 | 即使是同种酸,由于 ▲(3) 不同,它们的性质不完全相同。 |
|
| 两试管中均产生 ▲(4) | 不同的酸具 |
|
| E试管中产生 ▲(6) , F试管中无明显现象。 | 不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ. 废液缸中产生气体的化学方程式为 ▲(7) 。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有 ▲(8) (填化学式)。







 有相似的性质,这是因为酸的组成中都含有 ▲(5) (填元素符号)。
有相似的性质,这是因为酸的组成中都含有 ▲(5) (填元素符号)。