题目内容
14. 做完氢氧化钠与稀硫酸中和反应的实验后,兴趣小组的同学对反应后溶液中的溶质成分产生了兴趣,请你与他们一起进行以下探究.
做完氢氧化钠与稀硫酸中和反应的实验后,兴趣小组的同学对反应后溶液中的溶质成分产生了兴趣,请你与他们一起进行以下探究.【提出问题】溶液中的溶质是什么物质?
【作出猜想】
(1)甲同学认为溶液中的溶质只有Na2SO4一种物质.
(2)乙同学认为溶液中的溶质是Na2SO4和H2SO4两种物质.
(3)丙同学认为溶液中的溶质是Na2SO4和NaOH两种物质.
(4)丁同学认为溶液中的溶质是Na2SO4、NaOH和H2SO4
通过进一步讨论,大家一致认为以上丁(填甲、乙、丙、丁)同学的猜想肯定错误,无需实验验证.
【查阅资料】①Na2SO4溶液显中性.
②Al与强碱NaOH溶液反应生成偏铝酸钠(NaAlO2)等物质.
【实验验证】
| 实验操作 | 实验现象 | 实验结论 | |
| 乙同学 实验 | 取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管的溶液中 | 铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色 | 猜想(2)成立 |
| 丙同学 实验 | 取中和反应后的溶液少许于试管中,向试管中滴加几滴无色酚酞试液 | 溶液变红色 | 猜想(3)成立 |
【知识拓展】(1)生活中能否用铝制品来盛放强碱性溶液?不能(填“能”或“不能”)
(2)乙同学的实验中铝片与氢氧化钠溶液发生了反应,请写出铝与该溶液发生反应的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(3)镁和铝在元素周期表中处于相邻位置.向盛有100g稀硫酸的烧杯中加 入一定量的Mg粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示.
①计算该NaOH溶液溶质的质量分数.(要求写出计算过程)
②计算该100g稀硫酸中所含溶质硫酸的质量.(要求写出计算过程)
分析 【作出猜想】根据硫酸和氢氧化钠反应生成硫酸钠和水,两种物质可能恰好完全反应,也可能其中的一种物质过量进行分析;
【实验验证】根据氢氧化钠溶液显碱性,能使酚酞变红色进行分析;
【总结反思】根据氢氧化钠和硫酸反应生成硫酸钠和水,不能共存进行分析;
【知识拓展】(1)根据Al与强碱NaOH溶液反应生成偏铝酸钠(NaAlO2)等物质进行分析;
(2)根据铝和氢氧化钠反应会生成偏铝酸钠和氢气,氢气具有可燃性进行分析;
(3)根据反应的化学方程式结合数据解答即可.
解答 解:【作出猜想】硫酸和氢氧化钠反应生成硫酸钠和水,两种物质可能恰好完全反应,也可能其中的一种物质过量,但是不会同时剩余,故丁同学的猜想不正确,故填:丁;
【实验验证】氢氧化钠溶液显碱性,能使酚酞变红色,故填:红;
【总结反思】氢氧化钠和硫酸反应生成硫酸钠和水,不能共存,所以丁同学根据乙、丙两位同学的实验现象,首先肯定猜想(1)不成立.经过进一步分析,丁同学认为猜想(2)也不成立,他的理由是:滴入酚酞试液后,溶液变红色,说明溶液呈碱性,溶液中不可能含有硫酸;故填:滴入酚酞试液后,溶液变红色,说明溶液呈碱性,溶液中不可能含有硫酸;
【知识拓展】(1)Al与强碱NaOH溶液反应生成偏铝酸钠(NaAlO2)等物质,所以生活中不能用铝制品来盛放强碱性溶液;故填:不能;
(2)铝和氢氧化钠反应会生成偏铝酸钠和氢气,氢气具有可燃性,所以乙同学的实验中铝片与氢氧化钠溶液发生了反应,铝与氢氧化钠溶液发生反应生成偏铝酸钠和氢气,化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑.故填:氢氧化钠;2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)设:生成8.7gMg(OH)2消耗的NaOH的质量为x,氢氧化钠溶液反应所消耗硫酸溶质的质量为y,
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,
80 58
x 8.7g
则$\frac{80}{58}=\frac{x}{8.7g}$,解得x=12g,
氢氧化钠溶液中溶质质量分数为:$\frac{12g}{120g-80g}$×100%=30%,
答:氢氧化钠溶液中溶质质量分数为30%.
H2SO4消耗的NaOH的质量为:80g×30%=24g,
设与氢氧化钠反应所消耗硫酸溶质的质量为y.
H2SO4+2NaOH=Na2SO4+2H2O,
98 80
y 24g
则$\frac{98}{80}=\frac{y}{24g}$,解得y=29.4g,
故氢氧化钠溶液反应所消耗硫酸溶质的质量为29.4g.
而Mg+H2SO4=MgSO4+H2↑,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4;则:
设与镁粉反应所消耗硫酸溶质的质量为z.
H2SO4~MgSO4~Mg(OH)2,
98 58
z 8.7g
则$\frac{98}{58}=\frac{z}{8.7g}$,解得z=14.7g.
故与镁粉反应所消耗硫酸溶质的质量为14.7g.
故该100g稀硫酸中所含溶质硫酸的质量为:29.4g+14.7g=44.1g.
答:该NaOH溶液溶质的质量分数为30%;该100g稀硫酸中所含溶质硫酸的质量为44.1g.
点评 对反应后溶液组成成分进行猜想时,可根据反应物恰好完全反应或反应物之一过量进行分析,判断出反应后溶液的可能组成.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案(1)海水中含有大量的NaCl,可用于制备钠及其化合物,其流程如图:

①加入过量Na2CO3溶液目的是除去CaCl2和BaCl2,流程中不能用过量稀硫酸代替过量稀盐酸的原因是会生成新的杂质硫酸钠;
②提纯过程中使用了过滤和蒸发操作,实验室过滤和蒸发操作均使用到的玻璃仪器是玻璃棒;
③流程图中制备金属钠的化学方程式为2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑.
(2)工业上利用电解饱和食盐水的方法制备NaOH,并同时获得两种单质.补充并配平化学方程式:
□NaCl+□H2O□NaOH+□H2↑+□Cl2↑
(3)刘廷在实验室找到一瓶长期放置的NaOH溶液,欲对其成分进行实验探究.
【查阅资料】
I.NaOH与CO2分两步反应:
2NaOH+CO2═Na2CO3+H2O;Na2CO3+CO2+H2O═2NaHCO3
Ⅱ.NaOH与NaHCO3反应方程式为:NaOH+NaHCO3═Na2CO3+H2O
Ⅲ.物质的溶解性:
| CO32- | HCO3- | OH- | |
| Ba2+ | 不溶 | 溶 | 溶 |
【提出猜想】刘廷根据资料中的I、Ⅱ对其成分提出了5种合理猜想,请将猜想补充完整
猜想1:只有NaOH,猜想2:含有氢氧化钠、碳酸钠,猜想3:只有Na2CO3,猜想4:碳酸氢钠、碳酸钠,
猜想5:只有NaHCO3.
【实验验证】
| 步骤 | 操作 | 现象 | 结论 |
| 步骤1 | 取该NaOH溶液,加入过量BaCl2溶液 | 产生白色沉淀 | 证明猜想1、5不成立(填数字) |
| 步骤2 | 取步骤1中上层清液,滴加稀盐酸 | 无气泡产生 | 证明原溶液不含HCO3-、CO32-(填“离子”) |
| 步骤3 | 另取步骤1中上层清液,滴加酚酞 | 溶液未变红 | 证明原溶液不含OH-(填“离子”) |
| A. | I2O7 | B. | I2O3 | C. | I2O4 | D. | I2O5 |
 下列数据是硝酸钾固体在不同温度时的溶解度.
下列数据是硝酸钾固体在不同温度时的溶解度.| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
(2)20℃时,向50g水中加入15g硝酸钾,充分溶解后得到不饱和(填“饱和”或“不饱和”)溶液.
(3)20℃时,向100g水中加入35g 硝酸钾,若使硝酸钾完全溶解,可以采用的方法是增加溶剂质量或升高溶液温度.
(4)如图所示,小烧杯中盛放的是上述(2)中所得的硝酸钾溶液.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是A、C、D(填字母).
A.冰B.浓硫酸C.硝酸铵D.干冰E.氢氧化钠F.氧化钙.
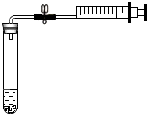 为测定空气中氧气的含量,小明同学设计如下方案:选用容积为40mL的试管作反应器,将白磷放入试管,用橡皮塞塞紧试管口,通过导管与容积为60mL针筒注射器组成如图的实验装置.假设此实验能按照小明的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:
为测定空气中氧气的含量,小明同学设计如下方案:选用容积为40mL的试管作反应器,将白磷放入试管,用橡皮塞塞紧试管口,通过导管与容积为60mL针筒注射器组成如图的实验装置.假设此实验能按照小明的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题: