题目内容
1.把下列金属投入相应的溶液中,有气泡产生的是( )| A. | 铁片投入稀盐酸中 | B. | 铜片投入稀硫酸中 | ||
| C. | 铝条投入硫酸铜溶液中 | D. | 镁条投入稀硫酸中 |
分析 在金属活动性顺序中,只有排在氢前面的金属才可以和稀酸溶液(除稀硝酸)反应生成氢气,排在氢后面的金属不能反应生成氢气,据此分析.
解答 解:A、在金属活动性顺序中,铁的金属性都在氢前,因此能够和稀盐酸反应产生氯化亚铁和氢气,故选项正确;
B、在金属活动性顺序中,铜排在氢后,不能和稀硫酸反应,故选项错误;
C、铝和硫酸铜反应产生硫酸铝和铜,没有气泡,故选项错误;
D、在金属活动性顺序中,镁的金属性都在氢前,能够和稀硫酸反应产生硫酸镁和氢气,故选项正确.
故选AD.
点评 本题难度不大,主要考查了根据反应的发生来判断金属的活动性强弱,从而加深学生对金属活动性顺序的理解和应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.如图是对四个实验绘制的图形,其中实验结果与对应图形正确的是( )
| A. |  向pH=13的氢氧化钠溶液中加入稀盐酸 | |
| B. |  向一定量的饱和的氯化钠溶液中加入氯化钠 | |
| C. |  等质量的锌粉和铁粉与足量的稀硫酸反应 | |
| D. |  向一定量Na2CO3和NaCl的混合溶液中滴加稀盐酸 |
6.下列物质中颜色为黑色的是( )
①氧化铜 ②炭粉 ③铁粉 ④铁片.
①氧化铜 ②炭粉 ③铁粉 ④铁片.
| A. | ①②③④ | B. | ①③ | C. | ①②③ | D. | ①②④ |
13.如图所示,经振荡后,能得到溶液的( )
| A. |  | B. |  | C. |  | D. |  |
 金属材料在人类社会中的使用历史悠久、领域广泛.
金属材料在人类社会中的使用历史悠久、领域广泛.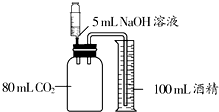 下列三个实验均可证明CO2能与NaOH溶液反应.
下列三个实验均可证明CO2能与NaOH溶液反应.