题目内容
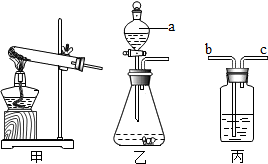
15.如图所示为实验室常见的气体制备、净化、收集和性质实验的部分仪器.试根据题目要求,回答下列问题: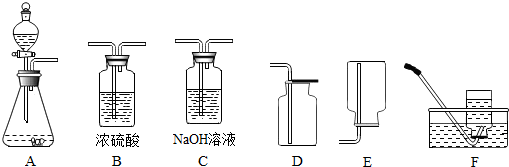
(1)小欣同学用过氧化氢溶液与二氧化锰为原料,在实验室制取并收集一瓶干燥的氧气.
①该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②所选仪器的连接顺序为ABD(填写仪器序号字母).
③反应完毕,从混合物中分离出二氧化锰的最佳方案是溶解、过滤、洗涤、干燥.
(2)某实验小组的同学用锌和稀硫酸反应制取氢气,并用来测定某氧化铜样品的纯度,其实验装置及实验数据如图表所示.(已知:样品中杂质不参与反应,H2+CuO═Cu+H2O,设各步均完全反应.)
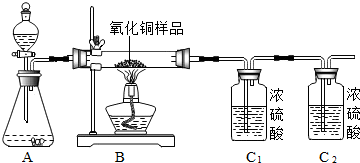
| 装置B中固体质量 | 装置C1的质量 | |
| 反应前 | 10.0克 | 150.8克 |
| 反应后 | 8.4克 | 152.8克 |
②乙同学通过测量反应前、后装置C1的质量变化,计算出该氧化铜样品的纯度为88.9%.试分析乙同学计算结果存在误差的原因:生成的氢气中混有的水蒸气.
请你对上图实验装置提出具体的改进措施:将C2装置放在AB装置之间.
分析 (1)据过氧化氢制取氧气的反应原理,氧气性质及化合物分离的方法解答;
(2)①根据质量守恒定律,反应应前后B中固体的质量差,即为反应中失去氧的质量,从而计算氧化铜的量;
②反应生成的氢气中混有的水蒸气,会导致结果偏大;
解答 解:①过氧化氢溶液与二氧化锰混合反应的方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②用过氧化氢溶液与二氧化锰为原料,在实验室制取并收集一瓶干燥的氧气,反应不需加热,发生装置选择A,用浓硫酸干燥,用向上排空气法收集,故连接顺序为:ABD;
③氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应后的残留物是氯化钾和二氧化锰的混合物;氯化钾易溶于水,二氧化锰难溶于水,可采用加水溶解、过滤、洗涤、干燥的方法分离出二氧化锰.
(2)①根据质量守恒定律可知:水中氧元素的质量=氧化铜中氧元素的质量,10g-8.4g=1.6g,反应应前后B中固体的质量差,即为反应中生成水中氧的质量,则氧化铜的质量是1.6÷$\frac{16}{80}$×100%=8g,然后求氧化铜样品的纯度=$\frac{8g}{10.0g}$×100%=80.0%;
②生成的氢气中混有的水蒸气,会导致结果偏大,改进措施是将C2装置放在AB装置之间,用浓硫酸吸收氢气中的水蒸气,然后在进行试验.
故答案为:(1)①2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;②ABD;③溶解、过滤、洗涤、干燥;
(2)①80.0%;②将C2装置放在AB装置之间.
点评 本考点主要考查了仪器的连接和气体的干燥,同时也考查了化学方程式的书写和有关的计算等,综合性比较强,本题能较好的考查学生分析、解决问题的能力.

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案| A. | 氧气作燃料 | B. | 干冰用于人工降雨 | ||
| C. | 氢氧化钠用于改良酸性土壤 | D. | 甲醛用于泡发鱿鱼等水产品 |
| A. |  加热液体 | B. |  检查装置气密性 检查装置气密性 | C. |  蒸发食盐水 | D. |  稀释浓硫酸 |
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度 g/100gH2O | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
②碳酸钠溶液中混有少量的氯化钠,可通过降温结晶(或冷却热的饱和溶液)的方法提纯;
③碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到的是饱和(填“饱和”或“不饱和”)溶液,将上述溶液升温到30℃,该溶液的溶质质量分数为23.1%.
| A. | 2个氢分子2H | B. | 4个水分子 4H2O | C. | 钴元素CO | D. | 3个氧原子O3 |
| A. | Fe、Cu、Al(SO4)3溶液 | B. | Al、Cu、FeSO4溶液 | ||
| C. | Fe、Al2(SO4)3溶液、CuSO4溶液 | D. | Al、Fe、Cu、稀H2SO4 |