题目内容
18.如图是实验室制取气体时常用的装置,根据装置回答下列问题:
(1)写出A装置中仪器的名称长颈漏斗(或锥形瓶).(写一种)
(2)用排水法收集氧气结束后先将导管移出水面,再熄灭酒精灯的原因防止水倒吸入热的试管,引起试管炸裂.写出用B装置制取氧气的化学反应方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)用双氧水和二氧化锰混合制取氧气,应选择的发生装置A(填序号) 若用F装置收集氧气,氧气应该从长(填“长”或“短”)导管导入.
(4)加热氯化铵和氢氧化钙的固体混合物生成氯化钙、氨气和水,氨气密度比空气小,极易溶于水.制取氨气的仪器组合AD(或AF).(填字母)写出制取氨气的化学反应方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O.
分析 (1)了解常用的仪器名称;
(2)B装置属于固体加热型,试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,并据反应原理和注意事项解答;
(3)双氧水和二氧化锰制取氧气属于固液常温型,故选发生装置A,氧气密度比空气大,所以应从长管进气;
(4)据反应物状态和反应条件选择发生装置,据气体密度和溶解性选择收集装置.
解答 解:(1)A装置中有长颈漏斗和锥形瓶;
(2)B装置属于固体加热型,试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,排水法收集氧气先移导管后熄灯,是为了防止水倒吸引起试管炸裂,反应方程式是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)双氧水和二氧化锰制取氧气属于固液常温型,故选发生装置A,氧气密度比空气大,所以应从长管进气;
(4)加热NH4Cl和Ca(OH)2固体混和物的方法制取氨气,属于固体加热型,故选发生装置A,氨气密度比空气小,极易溶于水,所以只能用向下排空气法收集,反应方程式是:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
故答案为:(1)长颈漏斗(或锥形瓶);
(2)防止水倒吸入热的试管,引起试管炸裂;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)A;长;
(4)AD(或AF);2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O.
点评 常见气体的制取是初中化学实验的重点和难点,也是历年中考中不可或缺的热点,学习时要掌握仪器的名称、用途,装置的选择相关化学方程式,实验注意事项等,能较好考查学生分析、解决问题的能力.

| A. | 缺钙会引起贫血 | B. | 缺锌易产生龋齿 | ||
| C. | 缺铁会引起食欲不振,生长迟缓 | D. | 缺碘会引起甲状腺肿大 |
| 选项 | 化学反应事实 | 影响因素 |
| A | 蜡烛在纯氧中燃烧的火焰比在空气中 燃烧的火焰更明亮 | 反应物浓度 |
| B | 煤粉比煤块燃烧得更加剧烈、更加充分 | 反应物种类 |
| C | 木炭在常温下不与氧气反应,点燃时能与氧气反应 | 反应温度 |
| D | 过氧化氢通常情况下难分解,加入二氧化锰后迅速分解 | 催化剂 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  | B. |  | C. |  | D. |  |
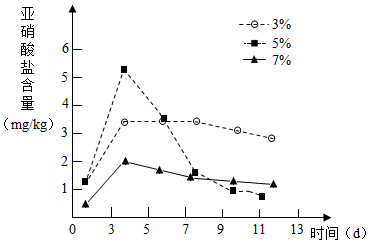 针对泡菜在发酵过程中会产生亚硝酸盐(致癌物质)的事实,某活动小组设计实验,探究不同食盐浓度和发酵时间对亚硝酸盐含量变化的影响,请回答:
针对泡菜在发酵过程中会产生亚硝酸盐(致癌物质)的事实,某活动小组设计实验,探究不同食盐浓度和发酵时间对亚硝酸盐含量变化的影响,请回答: 通过电解水实验可以研究水的组成.电解水的装置如右图3所示,该反应的化学方程式是2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
通过电解水实验可以研究水的组成.电解水的装置如右图3所示,该反应的化学方程式是2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.