题目内容
1811年意大利科学家阿伏加德罗提出了“相同体积的气体,在同温同压下具有相同数目的分子”的假说,后人通过大量实验证实了这种假说的正确性,并称其为阿伏加德罗定律.如图所示,有一充满H2、、O2混合气体的密闭容器,装有可左右移动的活塞,以保持密闭容器内压强始终与外界大气压相等.若点燃前后容器内温度均为20℃(此时水为液态,其体积可忽略不计),则点燃前容器内氢气与氧气的分子数之比为

- A.7:2
- B.16:5
- C.2:5
- D.10:11
BD
分析:根据题目信息可知,把分子个数比转化为体积之比.点燃后体积是2体积,说明氧气或者氢气剩余2体积,参加反应的气体的总体积是5体积.写出方程式并计算出氢气的氧气的体积.
解答:点燃后体积是2体积,说明氧气或者氢气剩余2体积,参加反应的气体的总体积是5体积.设参加反应的氢气的体积是X,则参加反应的氧气的体积是(5-X).
2H2+O2 2H2O
2H2O
2 1
X (5-X)
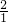 ═
═
得:X=
①当剩余的气体是氧气,则原来氢气的体积= ,氧气的体积=5-
,氧气的体积=5- +2═
+2═ ,则氢气和氧气的体积比=
,则氢气和氧气的体积比= :
: =10:11.
=10:11.
②当剩余的气体是氢气,则原来氢气的体积=2+ =
= ,氧气的体积=5-
,氧气的体积=5- ═
═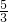 ,则氢气和氧气的体积比=
,则氢气和氧气的体积比= :
: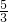 =16:5.
=16:5.
故答案为:B、D.
点评:本题的难点有两个:①把分子个数比转化为体积比;②分情况讨论.
分析:根据题目信息可知,把分子个数比转化为体积之比.点燃后体积是2体积,说明氧气或者氢气剩余2体积,参加反应的气体的总体积是5体积.写出方程式并计算出氢气的氧气的体积.
解答:点燃后体积是2体积,说明氧气或者氢气剩余2体积,参加反应的气体的总体积是5体积.设参加反应的氢气的体积是X,则参加反应的氧气的体积是(5-X).
2H2+O2
 2H2O
2H2O2 1
X (5-X)
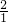 ═
═
得:X=

①当剩余的气体是氧气,则原来氢气的体积=
 ,氧气的体积=5-
,氧气的体积=5- +2═
+2═ ,则氢气和氧气的体积比=
,则氢气和氧气的体积比= :
: =10:11.
=10:11.②当剩余的气体是氢气,则原来氢气的体积=2+
 =
= ,氧气的体积=5-
,氧气的体积=5- ═
═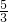 ,则氢气和氧气的体积比=
,则氢气和氧气的体积比= :
: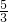 =16:5.
=16:5.故答案为:B、D.
点评:本题的难点有两个:①把分子个数比转化为体积比;②分情况讨论.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

