题目内容
6.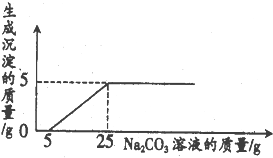 实验室废液桶中收集到大量含有盐酸与氯化钙的废液,取100g废液向其中慢慢滴加溶质质量分数为26.5%的Na2CO3溶液,加人Na2CO3溶液的质量与生成沉淀的质量关系如下图所示.请计算回答下列问题:
实验室废液桶中收集到大量含有盐酸与氯化钙的废液,取100g废液向其中慢慢滴加溶质质量分数为26.5%的Na2CO3溶液,加人Na2CO3溶液的质量与生成沉淀的质量关系如下图所示.请计算回答下列问题:(1)在加入Na2CO3溶液的过程中,开始时没有生成沉淀的原因是碳酸钠先和稀盐酸反应生成氯化钠、水和二氧化碳
(2)求废液中所含氯化钙的质量分数.
(3)求完全反应后所得溶液中溶质的质量分数.
分析 碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,和氯化钙反应生成碳酸钙沉淀和氯化钠,根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)在加入Na2CO3溶液的过程中,开始时没有生成沉淀的原因是碳酸钠先和稀盐酸反应生成氯化钠、水和二氧化碳.
故填:碳酸钠先和稀盐酸反应生成氯化钠、水和二氧化碳.
(2)设氯化钙质量为x,生成碳酸钙质量为y,生成氯化钠质量为z,
由图中信息可知,和氯化钙反应的碳酸钠质量为:(25g-5g)×26.5%=5.3g,
Na2CO3+CaCl2═CaCO3↓+2NaCl,
106 111 100 117
5.3g x y z
$\frac{106}{5.3g}$=$\frac{111}{x}$=$\frac{100}{y}$=$\frac{117}{z}$,
x=5.55g,y=5g,z=5.85g,
废液中所含氯化钙的质量分数为:$\frac{5.55g}{100g}$×100%=5.55%,
答:氯化钙质量分数是5.55%.
(3)设碳酸钠和稀盐酸反应生成氯化钠质量为m,生成二氧化碳质量为n,
由图中信息可知,和稀盐酸反应的碳酸钠质量为:5g×26.5%=1.325g,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
106 117 44
1.325g m n
$\frac{106}{1.325g}$=$\frac{117}{m}$=$\frac{44}{n}$,
m=1.4625g,n=0.55g,
完全反应后所得溶液中溶质的质量分数为:$\frac{5.85g+1.4625g}{100g+25g-5g-0.55g}$×100%=6.1%,
答:完全反应后所得溶液中溶质的质量分数是6.1%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 草木灰水的碱性最强 | B. | 橘子汁显碱性 | ||
| C. | 柠檬的酸性比橘子弱 | D. | 萝卜显中性 |
| A. |  巢湖银鱼 巢湖银鱼 | B. |  合肥烘糕 合肥烘糕 | C. |  八公山豆腐 八公山豆腐 | D. |  宿州符离集烧鸡 宿州符离集烧鸡 |
| A. | 硬水和软水可以用肥皂水鉴别 | |
| B. | 生活中通过煮沸水可以降低水的硬度 | |
| C. | 水是一种最常用的溶剂 | |
| D. | 吸附主要除去的是不溶性杂质 |

| A. | 该反应涉及到四种原子 | |
| B. | 参加反应的两种分子的个数比为1:1 | |
| C. | 该反应属于置换反应 | |
| D. | 该反应前后所有元素的化合价都没有变化 |
| A. | 矿石粉碎 | B. | 糯米酿酒 | C. | 冰雪消融 | D. | 锅炉爆炸 |