题目内容
13.某科学兴趣小组的同学为了测定某不纯氧化铁试样(其中的杂质不参与反应)中氧化铁的质量分数,设计了如下图的实验装置:试回答下列问题:
(1)C中硬质玻管内发生的化学方程式3H2+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O;
(2)10克不纯氧化铁试样放入C中硬质玻管内,称得U形管和氯化钙干燥剂的质量为23.4克,按上述装置进行实验,经过充分反应后称得U形管和氯化钙干燥剂的质量为26.1克,则试样中氧化铁的质量分数为80%.
分析 (1)根据其中的反应原理及实质来分析;
(2)根据U形管和氯化钙干燥剂的质量增加的部分即为生成水的质量进一步计算出氧化铁的质量,然后计算出氧化铁的质量分数.
解答 解:(1)氢气和氧化铁加热反应生成铁和水,故填:3H2+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O;
(2)生成水的质量为:26.1g-23.4g=2.7g,设氧化铁的质量为x
3H2+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O
160 54
x 2.7g
$\frac{160}{54}=\frac{x}{2.7g}$
x=8g
故氧化铁的质量分数为$\frac{8g}{10g}×100%$=80%.
故填:80%.
点评 题考查的知识点较多,知识面较广;是一道比较复杂的综合实验分析题.解答时,一定要细心、认真地进行分析探究,并进行科学合理的推断和设计、评价实验方案等.

练习册系列答案
相关题目
4. 在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块.
在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块.
【提出问题】结块后的固体成分是什么?
【猜想与假设】
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠.
用化学方程式表示固体中有碳酸钠的原因:2NaOH+CO2═Na2CO3+H2O.
【查阅资料】
Na2CO3溶液pH>7,BaCl2溶液pH=7,Na2CO3+BaCl2=BaCO3↓+2NaCl
【进行实验】
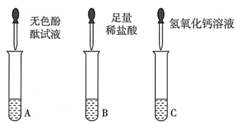
从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C三支试管,进行如下实验.
【实验分析】
甲、乙、丙同学分别得出如下的结论:
甲同学:向B试管的溶液中滴加足量的稀盐酸,产生大量无色气体,则固体为Na2CO3,B试管中现象产生的原因是Na2CO3+2HCl=2NaCl+H2O+CO2↑(用化学方程式表示).
乙同学:向A试管的溶液中加入几滴无色酚酞试液,溶液变红,则固体中一定含有NaOH.
丙同学:向溶液中加入Ca(OH)2溶液,有白色沉淀产生,再向上层清液中滴加无色酚酞试液,溶液变红色,则固体为NaOH和Na2CO3.
【反思与评价】
丁同学认真分析上述三位同学的实验,认为他们的结论均有不足之处,并且做了正确的判断.
他认为固体中一定含有Na2CO3,可能含有NaOH.
为进一步确认猜想二正确,请你帮助他设计实验进行验证.
【实验反思】
(1)试剂瓶中的固体结块的原因可能是氢氧化钠吸水潮解.
(2)在溶解固体时放出了一定的热量,依据此现象有同学认为该固体中一定有氢氧化钠,为验证该同学的结论是否正确,还应该进行的实验是取碳酸钠固体将其溶解,观察是否有放热现象.
(3)二氧化碳气体通入到氢氧化钠溶液中,戊同学说可以证明二者发生了反应,你同意(选填“同意”或“不同意”)戊同学的观点,理由是二氧化碳的体积会减少.
【实验反思】
戊同学又用下图所示装置进行实验来探究二氧化碳是否与氢氧化钠溶液反应.
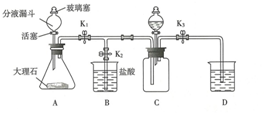
(1)收集一瓶二氧化碳:打开止水夹K1和K3,关闭K2,从分液漏斗向装置A中加入足量的稀盐酸,写出A中发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.
当看到D中有大量浑浊产生时,CO2已集满,写出D中发生的化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)证明二氧化碳与氢氧化钠发生了化学反应:
关闭止水夹K1和K3,打开止水夹K2,从分液漏斗C中加入适量滴有酚酞的氢氧化钠溶液,直至实验结束,请写出C中发生反应的化学方程式:2NaOH+CO2=Na2CO3+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑.C中观察到的现象中,能证明CO2与NaOH确实发生了化学反应的是C中有气泡产生.
 在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块.
在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块.【提出问题】结块后的固体成分是什么?
【猜想与假设】
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠.
用化学方程式表示固体中有碳酸钠的原因:2NaOH+CO2═Na2CO3+H2O.
【查阅资料】
Na2CO3溶液pH>7,BaCl2溶液pH=7,Na2CO3+BaCl2=BaCO3↓+2NaCl
【进行实验】
从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C三支试管,进行如下实验.
【实验分析】
甲、乙、丙同学分别得出如下的结论:
甲同学:向B试管的溶液中滴加足量的稀盐酸,产生大量无色气体,则固体为Na2CO3,B试管中现象产生的原因是Na2CO3+2HCl=2NaCl+H2O+CO2↑(用化学方程式表示).
乙同学:向A试管的溶液中加入几滴无色酚酞试液,溶液变红,则固体中一定含有NaOH.
丙同学:向溶液中加入Ca(OH)2溶液,有白色沉淀产生,再向上层清液中滴加无色酚酞试液,溶液变红色,则固体为NaOH和Na2CO3.
【反思与评价】
丁同学认真分析上述三位同学的实验,认为他们的结论均有不足之处,并且做了正确的判断.
他认为固体中一定含有Na2CO3,可能含有NaOH.
为进一步确认猜想二正确,请你帮助他设计实验进行验证.
| 实验操作 | 实验现象 | 实验结论 |
猜想二正确 |
(1)试剂瓶中的固体结块的原因可能是氢氧化钠吸水潮解.
(2)在溶解固体时放出了一定的热量,依据此现象有同学认为该固体中一定有氢氧化钠,为验证该同学的结论是否正确,还应该进行的实验是取碳酸钠固体将其溶解,观察是否有放热现象.
(3)二氧化碳气体通入到氢氧化钠溶液中,戊同学说可以证明二者发生了反应,你同意(选填“同意”或“不同意”)戊同学的观点,理由是二氧化碳的体积会减少.
【实验反思】
戊同学又用下图所示装置进行实验来探究二氧化碳是否与氢氧化钠溶液反应.

(1)收集一瓶二氧化碳:打开止水夹K1和K3,关闭K2,从分液漏斗向装置A中加入足量的稀盐酸,写出A中发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.
当看到D中有大量浑浊产生时,CO2已集满,写出D中发生的化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)证明二氧化碳与氢氧化钠发生了化学反应:
关闭止水夹K1和K3,打开止水夹K2,从分液漏斗C中加入适量滴有酚酞的氢氧化钠溶液,直至实验结束,请写出C中发生反应的化学方程式:2NaOH+CO2=Na2CO3+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑.C中观察到的现象中,能证明CO2与NaOH确实发生了化学反应的是C中有气泡产生.
8.实验室常用氢氧化钠溶液来吸收过剩的氯气,其反应可用下列化学方程式表示:2NaOH+Cl2═NaClO+R+H2O.在该化学反应中,生成物R的化学式为( )
| A. | NaCl | B. | HCl | C. | HClO | D. | H2 |

