题目内容
将3.1g红磷分别在给定质量的氧气中充分反应,其实验数据如下:
| 第一次 | 第二次 | 第三次 | |
| 给定氧气的质量(g) | 2 | 8 | 14 |
| 生成五氧化二磷的质量(g) | 3.55 | 7.1 | 7.1 |
(1)这三次实验是否符合质量守恒定律?________为什么?________.
(2)第一次实验为什么不生成5.1g五氧化二磷?________.
(3)第二次实验为什么不生成11.1g五氧化二磷?________.
解:设与3.1g红磷完全反应需氧气的质量为 x,生成五氧化二磷的质量为y
4P+5O2 2P2O5
2P2O5
124 160 284
3.1g x y
 =
=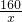 =
=
x=4g y=7.1g
故答案为:
(1)符合,都是化学变化,所以都遵循质量守恒定律.
(2)因为红磷过量没有完全参加反应.
(3)因为氧气过量没有完全参加反应.
分析:根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.由磷与氧气反应的方程式求出磷与氧气恰好完全反应的质量比,以及完全反应时生成的五氧化二磷的质量,就可以判断分析回答.
点评:本题结合实例考查学生对质量守恒定律的理解,质量守恒定律中的“质量”是指“参加”化学反应的反应物的质量,不是反应物的任意质量的简单相加.
4P+5O2
 2P2O5
2P2O5124 160 284
3.1g x y
 =
=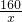 =
=
x=4g y=7.1g
故答案为:
(1)符合,都是化学变化,所以都遵循质量守恒定律.
(2)因为红磷过量没有完全参加反应.
(3)因为氧气过量没有完全参加反应.
分析:根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.由磷与氧气反应的方程式求出磷与氧气恰好完全反应的质量比,以及完全反应时生成的五氧化二磷的质量,就可以判断分析回答.
点评:本题结合实例考查学生对质量守恒定律的理解,质量守恒定律中的“质量”是指“参加”化学反应的反应物的质量,不是反应物的任意质量的简单相加.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
将3.1g红磷分别在给定质量的氧气中充分反应,其实验数据如下:
通过计算回答:
(1)这三次实验是否符合质量守恒定律? 为什么? .
(2)第一次实验为什么不生成5.1g五氧化二磷? .
(3)第二次实验为什么不生成11.1g五氧化二磷? .
| 第一次 | 第二次 | 第三次 | |
| 给定氧气的质量(g) | 2 | 8 | 14 |
| 生成五氧化二磷的质量(g) | 3.55 | 7.1 | 7.1 |
(1)这三次实验是否符合质量守恒定律?
(2)第一次实验为什么不生成5.1g五氧化二磷?
(3)第二次实验为什么不生成11.1g五氧化二磷?
将3.1g红磷分别在给定质量的氧气中充分反应,甲、乙、丙三位同学得出生成五氧化二磷的数据如下表所示:
通过计算回答:
(1)哪位同学的结果是正确的?
(2)帮助结果不正确的同学分析原因.
| 物质的质量 | 甲 | 乙 | 丙 |
| 给定氧气的质量(克) | 2 | 4 | 8 |
| 五氧化二磷的质量(克) | 5.1 | 7.1 | 7.1 |
(1)哪位同学的结果是正确的?
(2)帮助结果不正确的同学分析原因.
将3.1g红磷分别在给定质量的氧气中充分反应,其实验数据如下:
通过计算回答:
(1)这三次实验是否符合质量守恒定律?______为什么?______.
(2)第一次实验为什么不生成5.1g五氧化二磷?______.
(3)第二次实验为什么不生成11.1g五氧化二磷?______.
| 第一次 | 第二次 | 第三次 | |
| 给定氧气的质量(g) | 2 | 8 | 14 |
| 生成五氧化二磷的质量(g) | 3.55 | 7.1 | 7.1 |
(1)这三次实验是否符合质量守恒定律?______为什么?______.
(2)第一次实验为什么不生成5.1g五氧化二磷?______.
(3)第二次实验为什么不生成11.1g五氧化二磷?______.