题目内容
4.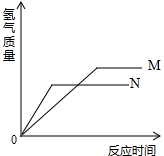 等质量的M、N两种金属,分别与相同质量分数、等质量的稀盐酸反应成生氢气质量和反应时间的关系如图所示.
等质量的M、N两种金属,分别与相同质量分数、等质量的稀盐酸反应成生氢气质量和反应时间的关系如图所示.(1)下列说法符合图示的是A;
A.M的活动性<N B.M与N均完全反应
C.相对原子质量较大的一定是N D.稀盐酸一定都有剩余
(2)若M是铝,则N可能是B.
A.铜 B.镁 C.锌 D.铁.
分析 根据金属与酸反应的情况进行分析,金属的活动性越强,与酸反应的速率越快,在坐标中的斜线越陡,当金属足量时,酸全部参加反应,生成的氢气质量相同,当酸足量时,金属全部参加反应,当金属的化合价相同时,相对原子质量大的金属生成的氢气质量少.
解答 解:(1)A、从图象可以看出,N比M陡,则N的活动性强于M,故A正确;
B、生成氢气的质量不同,不能说明M和N全部参加反应,存在M剩余的情况,故B错误;
C、没有告诉生成的盐中金属的化合价是否相同,故不能确定N的相对原子质量一定大于M,故C错误;
D、生成氢气的质量不同,可能与M反应的盐酸全部参加反应,而与N反应的盐酸有剩余,故D错误.
故选:A;
(2)若M是铝,则N的活动性强于M,观察选项,故选:B.
故答案为:(1)A;
(2)B.
点评 本题考查了金属与酸反应的知识,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
相关题目
12. 某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2).该小组同学对该气体的成分进行如下探究.
某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2).该小组同学对该气体的成分进行如下探究.
猜想与假设】忠旭说:该气体可能是CO2、O2、CO、H2、N2.
宇龙同学说:不可能含有N2,因为根据质量守恒定律可知,化学反应前后元素种类不变,反应物中不含氮元素;
心如同学说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO有毒;
鸿宇同学认为:该气体可能含有CO2、O2中的一种或两种.
【进行实验】
【得出结论】(1)由实验①可知,该气体中肯定含有二氧化碳;
(2)由实验②不能(填“能”或“不能”)确定该气体中不含氧气,理由是若生成氧气和二氧化碳的混合物,当氧气含量过少时,带火星的木条也不能复燃.
 某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2).该小组同学对该气体的成分进行如下探究.
某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2).该小组同学对该气体的成分进行如下探究.猜想与假设】忠旭说:该气体可能是CO2、O2、CO、H2、N2.
宇龙同学说:不可能含有N2,因为根据质量守恒定律可知,化学反应前后元素种类不变,反应物中不含氮元素;
心如同学说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO有毒;
鸿宇同学认为:该气体可能含有CO2、O2中的一种或两种.
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 将气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
| ② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(2)由实验②不能(填“能”或“不能”)确定该气体中不含氧气,理由是若生成氧气和二氧化碳的混合物,当氧气含量过少时,带火星的木条也不能复燃.
13.下列自来水厂净化水的各过程中属于化学变化的是( )
| A. | 静置沉淀 | B. | 砂石过滤 | C. | 活性炭吸附 | D. | 氯气消毒 |

 指出如图操作中的错误之处可能引起的后果,并加以改正
指出如图操作中的错误之处可能引起的后果,并加以改正