题目内容
通过化学学习,应该知道有多种途径可以制取氧气.如:
A.电解水B.分离空气 C.加热高锰酸钾D.分解过氧化氢 E.
(1)相信你在E处还可以写出另一种制取氧气的方法;
(2)若用图1装置加热高锰酸钾制取氧气,实验结束,停止加热时要先把导管移出水面,其理由 ,此时发现水槽中的水变成了浅紫红色,你认为产生该现象的原因可能是 ;
(3)若分解过氧化氢制取氧气,供选用的装置如下:
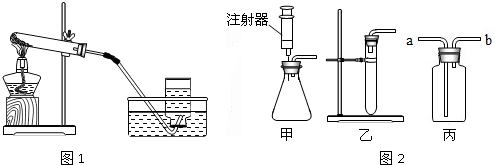
要得到平稳的氧气流,应选用的发生装置是 (选填“甲”或“乙”);若用丙装置干燥生成的氧气,丙中盛放的液体试剂是浓硫酸,气体应从 (选填“a”或“b”)端导入.
(4)用排水法收集氧气,当气泡 时,再开始收集;
(5)写出实验室加热高锰酸钾制氧气的化学反应方程式:
(6)研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需的时间
问题:从上表中能得出哪些结论?(只任写一条即可) .
A.电解水B.分离空气 C.加热高锰酸钾D.分解过氧化氢 E.
(1)相信你在E处还可以写出另一种制取氧气的方法;
(2)若用图1装置加热高锰酸钾制取氧气,实验结束,停止加热时要先把导管移出水面,其理由
(3)若分解过氧化氢制取氧气,供选用的装置如下:

要得到平稳的氧气流,应选用的发生装置是
(4)用排水法收集氧气,当气泡
(5)写出实验室加热高锰酸钾制氧气的化学反应方程式:
(6)研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需的时间
| 浓度 时间(min) 条件 | 30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入a g Fe2O3 | 7.0 | 9.0 | 16.0 |
考点:氧气的制取装置,气体的干燥(除水),氧气的收集方法,制取氧气的操作步骤和注意点,催化剂的特点与催化作用,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)据制取氧气的方法可知:还可用加热氯酸钾的方法制取氧气;
(2)据加热高锰酸钾制取氧气的注意事项解答;
(3)要得到平稳的氧气流,则须控制反应物的量,据此分析,洗气装置中导管要长进短出;
(4)排水法收集气体时要等气泡连续、均匀冒出再收集,防止收集的气体不纯;
(5)据加热高锰酸钾的反应原理书写方程式;
(6)据表格数据可知:相同条件下,MnO2的催化效果比Fe2O3好,在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快.
(2)据加热高锰酸钾制取氧气的注意事项解答;
(3)要得到平稳的氧气流,则须控制反应物的量,据此分析,洗气装置中导管要长进短出;
(4)排水法收集气体时要等气泡连续、均匀冒出再收集,防止收集的气体不纯;
(5)据加热高锰酸钾的反应原理书写方程式;
(6)据表格数据可知:相同条件下,MnO2的催化效果比Fe2O3好,在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快.
解答:解:(1)据制取氧气的方法可知:还可用加热氯酸钾的方法制取氧气;
(2)实验结束,停止加热时要先把导管移出水面,是为了防止水倒流引起试管炸裂,发现水槽中的水变成了浅紫红色,可能是试管口未放棉花,高锰酸钾粉末进入水槽溶于水所致;
(3)分解过氧化氢制取氧气不需加热,属于固液常温型,可用甲、乙,要得到平稳的氧气流,则须控制反应物的量,注射器可控制液体的滴加速度,从而可控制反应速率得到平稳的氧气流;用乙装置分解过氧化氢时,反应速率由快到慢,不能得到平稳的氧气流;若用丙装置干燥生成的氧气,丙中盛放的液体试剂是浓硫酸,气体应从短管进入,与浓硫酸充分接触;
(4)排水法收集气体时要等气泡连续、均匀冒出再收集,防止收集的气体不纯;
(5)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,反应方程式是:2KMnO4
K2MnO4+MnO2+O2↑;
(6)据表格数据可知:相同条件下,MnO2的催化效果比Fe2O3好,在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快;
故答案为:(1)加热分解氯酸钾;
(2)防止水倒流引起试管炸裂; 试管口没塞棉花;
(3)甲; a;
(4)气泡连续均匀冒出;
(5)2KMnO4
K2MnO4+MnO2+O2↑;
(6)相同条件下,MnO2的催化效果比Fe2O3好(合理均可).
(2)实验结束,停止加热时要先把导管移出水面,是为了防止水倒流引起试管炸裂,发现水槽中的水变成了浅紫红色,可能是试管口未放棉花,高锰酸钾粉末进入水槽溶于水所致;
(3)分解过氧化氢制取氧气不需加热,属于固液常温型,可用甲、乙,要得到平稳的氧气流,则须控制反应物的量,注射器可控制液体的滴加速度,从而可控制反应速率得到平稳的氧气流;用乙装置分解过氧化氢时,反应速率由快到慢,不能得到平稳的氧气流;若用丙装置干燥生成的氧气,丙中盛放的液体试剂是浓硫酸,气体应从短管进入,与浓硫酸充分接触;
(4)排水法收集气体时要等气泡连续、均匀冒出再收集,防止收集的气体不纯;
(5)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,反应方程式是:2KMnO4
| ||
(6)据表格数据可知:相同条件下,MnO2的催化效果比Fe2O3好,在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快;
故答案为:(1)加热分解氯酸钾;
(2)防止水倒流引起试管炸裂; 试管口没塞棉花;
(3)甲; a;
(4)气泡连续均匀冒出;
(5)2KMnO4
| ||
(6)相同条件下,MnO2的催化效果比Fe2O3好(合理均可).
点评:本题考查较为全面,但难度不大,据相关知识细心分析解答即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组中的物质完全反应后形成溶液的质量比反应前溶液的总质量大的是( )
| A、碳酸钠溶液和稀盐酸 |
| B、铜和硝酸银溶液 |
| C、二氧化碳和氢氧化钠溶液 |
| D、氢氧化钡溶液和氣化镁溶液 |
鱼肝油的主要成分之一是维生素D3,它的化学式为C27H44O.下列有关说法正确的是( )
| A、维生素D3的相对分子质量为384g |
| B、维生素D3由三种元素组成 |
| C、维生素D3中碳、氢元素的质量比为27:44 |
| D、维生素D3由27个碳原子、44个氢原子和1个氧原子构成 |
 A用五个圆表示A(O2)、B(C)、C(CuO)、D(CO2)、E(石灰水)五种物质用两圆相切表示两种物质可以发生反应.请回答下列问题:
A用五个圆表示A(O2)、B(C)、C(CuO)、D(CO2)、E(石灰水)五种物质用两圆相切表示两种物质可以发生反应.请回答下列问题: