题目内容
5.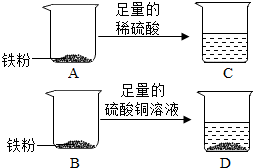 实验室有一包纯净的铁粉,小明为了探究金属的化学性质并测定铁的相对原子质量,设计了如图所示的实验.
实验室有一包纯净的铁粉,小明为了探究金属的化学性质并测定铁的相对原子质量,设计了如图所示的实验.【实验步骤】①取两份质量同为w克的铁粉,分别置于质量相等的A、B烧杯中.
②向装有铁粉的A烧杯中加入50克足量的稀硫酸;向装有铁粉的B烧杯中加入50克足量的硫酸铜溶液.
③充分反应后进行称量.C烧杯和烧杯内物质的总质量为m克,D烧杯和烧杯内物质的总质量为n克.
(1)请写出C烧杯中发生反应的化学方程式Fe+H2SO4═FeSO4+H2↑.通过C烧杯中发生的化学反应,你能得出的结论是铁能置换出酸中的氢.
(2)D烧杯中发生反应的化学方程式为CuSO4+Fe═FeSO4+Cu.此反应可以证明铁的金属活动性比铜强(填“强”或“弱”).
(3)铁的相对原子质量的表达式为$\frac{2w}{n-m}$.
分析 (1)依据铁能与稀硫酸反应生成氢气和硫酸亚铁书写方程式并得到结论;
(2)依据铁的活动性比铜强,所以铁能置换出硫酸铜中的铜分析解答;
(3)依据D烧杯中反应后物质的总质量结合质量守恒定律求出烧杯的质量,而后依据铁与稀硫酸的反应求出生成氢气的质量,进而求出铁的原子质量;
解答 解:(1)铁的活动性在氢前,所以铁能与稀硫酸反应生成氢气和硫酸亚铁,其方程式为Fe+H2SO4═FeSO4+H2↑.
(2)由金属活动性顺序表可知铁的活动性比铜强,所以铁能置换出硫酸铜中的铜,其方程式为CuSO4+Fe═FeSO4+Cu;
(3)因为D烧杯中反应后物质的总质量是n克,而依据质量守恒定律可知反应后D烧杯中物质的总质量是(50+w)克,所以烧杯的质量为:n克-(50+w)克;所以铁与稀硫酸的反应生成氢气的质量是50克+w克-{m克-[n克-(50+w)克]}=(n-m)克
设铁的相对原子质量是x
Fe+H2SO4═FeSO4+H2↑
x 2
wg (n-m)g
$\frac{x}{wg}=\frac{2}{(n-m)g}$
x=$\frac{2w}{n-m}$
故答案为:(1)Fe+H2SO4═FeSO4+H2↑;铁能置换出酸中的氢;(2)CuSO4+Fe═FeSO4+Cu;强;(3)$\frac{2w}{n-m}$;
点评 此题是对铁发生的置换反应的考查,掌握金属活动性顺序的意义以及应用,以及化学方程式的有关计算是解题的关键.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
20.小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
(1)小亮查阅氢氧化钙常温下的溶解度约为0.17g后,认为该溶液不可能是氢氧化钙,理由是Ca(OH)2微溶于水,其溶液中溶质质量分数不可能为10%.
(2)小亮取少量样品于试管中,滴加酚酞溶液,溶液变红色,该溶液不可能是
NaCl(填写化学式),理由是NaCl溶液呈中性,不能使无色酚酞溶液变红色.
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请你一起参与,并填写下列实验报告.
[设计实验方案]方案甲:选择氯化钙溶液来确定该溶液的成份;
方案乙:选择稀盐酸来确定该溶液的成份.
[进行实验]你愿意选择方案甲(选填“甲”或“乙”)进行实验.
[实验反思](1)有同学认为还可以用一种常见的碱溶液来确定,那么它是氢氧化钙溶液.
(2)小亮经过反思,向同学们提出如下建议,你认为合理的是AB(填序号).
A.倾倒液体时应注意保护标签不被腐蚀
B.要有严谨的科学实验的态度
C.无法辨认的药品,直接倒掉,无需保留.
(1)小亮查阅氢氧化钙常温下的溶解度约为0.17g后,认为该溶液不可能是氢氧化钙,理由是Ca(OH)2微溶于水,其溶液中溶质质量分数不可能为10%.
(2)小亮取少量样品于试管中,滴加酚酞溶液,溶液变红色,该溶液不可能是
NaCl(填写化学式),理由是NaCl溶液呈中性,不能使无色酚酞溶液变红色.
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请你一起参与,并填写下列实验报告.
[设计实验方案]方案甲:选择氯化钙溶液来确定该溶液的成份;
方案乙:选择稀盐酸来确定该溶液的成份.
[进行实验]你愿意选择方案甲(选填“甲”或“乙”)进行实验.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加氯化钙溶液. | 产生白色沉淀 | 该溶液是碳酸钠溶液. 有关反应的化学方程式为: CaCl2+Na2CO3=CaCO3↓+2NaCl. |
(2)小亮经过反思,向同学们提出如下建议,你认为合理的是AB(填序号).
A.倾倒液体时应注意保护标签不被腐蚀
B.要有严谨的科学实验的态度
C.无法辨认的药品,直接倒掉,无需保留.
13.下列化合物中氯元素的化合价为+5的是( )
| A. | Cl2 | B. | KClO3 | C. | HClO | D. | KCl |
10.如图1所示A~F是实验室制备某些常见气体的装置示意图.
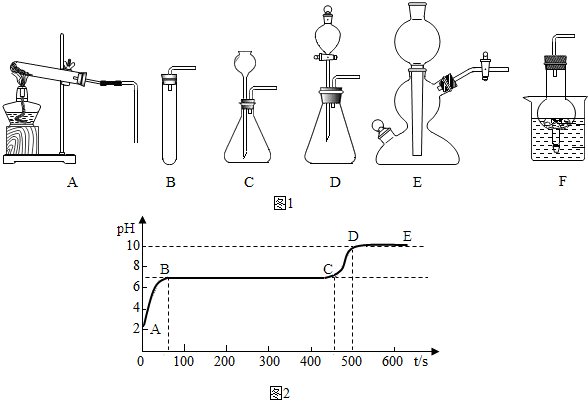
(1)实验室制备CO2的药品为石灰石和稀盐酸可用的发生装置有:BCDEF(选填上图字母序号).
(2)装置E或F相对于装置C在操作方面的优势为:随开随用,随关随停.
(3)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
(4)块状石灰石和适量稀盐酸反应至无气泡逸出后,测得其残留液pH等于2.此时取适量反应后溶液,逐滴滴入碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如图2所示[pH为纵坐标,时间s(秒)为横坐标]:
①写出AB段内有关化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑
②写出BC“平台”段化学方程式CaCl2+Na2CO3═CaCO3↓+2NaCl
③CD段上升的原因是:盐酸和氯化钙已经完全反应,碳酸钠剩余,溶液呈碱性.

(1)实验室制备CO2的药品为石灰石和稀盐酸可用的发生装置有:BCDEF(选填上图字母序号).
(2)装置E或F相对于装置C在操作方面的优势为:随开随用,随关随停.
(3)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且不与空气中的成分反应 |
| 收集过程分析 | 集满现象瓶口有大气泡冒出 | “验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭, 也难以证明空气完全排尽 |
| 向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短 | 先浑浊后变澄清所需时间较长 |
| 由上述实验可得结论 | ①用排水法收集满二氧化碳现象明显; ②排水法收集到的二氧化碳纯度更高. | |
①写出AB段内有关化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑
②写出BC“平台”段化学方程式CaCl2+Na2CO3═CaCO3↓+2NaCl
③CD段上升的原因是:盐酸和氯化钙已经完全反应,碳酸钠剩余,溶液呈碱性.
17.对天宫一号目标飞行器内镍氢电池的总反应式:H2+2NiO(OH)=2Ni(OH)2,下列叙述不正确的是( )
| A. | H2是非金属单质 | |
| B. | H元素与Ni 元素在反应前后化合价均发生变化 | |
| C. | NiO(OH)中Ni化合价为+2价 | |
| D. | 该反应为化合反应 |
15.逻辑推理是一种重要的化学思维方法.以下推理合理的是( )
| A. | 因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有C和H | |
| B. | 因为中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| C. | 因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 | |
| D. | 因为碱溶液呈碱性,所以呈碱性的溶液一定都是碱溶液 |
 A、B、C三种物质的溶解度曲线如图所示.请回答:
A、B、C三种物质的溶解度曲线如图所示.请回答: