题目内容
12. 水是生命之源.
水是生命之源.(1)生活中常用肥皂水来区分硬水和软水;
(2)电解水实验如图所示,与直流电源正极相连的玻璃管中生成的气体是氧气;
(3)配制500g溶质质量分数为10%的葡萄糖溶液,需葡萄糖和水的质量为50g 450g.
分析 (1)根据硬水和软水与肥皂水混合的现象不同解答;
(2)电解水时根据“正氧负氢、氢二氧一”进行解答;
(3)根据溶质质量分数计算进行解答即可.
解答 解:
(1)硬水和软水与肥皂水混合的现象不同,可以使用肥皂水鉴别硬水和软水;
(2)电解水时正极产生的是氧气,负极产生的是氢气;
(3)配制500g溶质的质量分数为10%的葡萄糖溶液,需葡萄糖的质量为:500g×10%=50g,需要水的质量为500g-50g=450g;
故答案为:(1)肥皂水(2)氧气(3)50g 450g
点评 本题考查了水的净化的知识,完成此题,可以依据已有的知识进行.电解水实验图可知,与直流电源正极相连的玻璃管中生成的气体是氧气,负极产生的气体是氢气

练习册系列答案
相关题目
8.下列化学方程式书写正确、符合题意且属于基本反应类型的是( )
| A. | 用火碱溶液吸收二氧化硫SO2+2NaOH═Na2SO3+H2O | |
| B. | 植物的光合作用C6H12O6+6O2 $→_{光照}^{叶绿素}$6CO2+6H2O | |
| C. | 碳酸饮料中碳酸的形成原理CO2+H2O═H2CO3 | |
| D. | 利用一氧化碳的还原性得到金属铁2Fe2O3+3CO═4Fe+3CO2↑ |
7.下列应用和相应的原理(用化学方程式表示)及基本反应类型正确的是( )
| 选项 | 物质的应用 | 化学方程式 | 反应类型 |
| A | 电解水 | 2H202$\frac{\underline{\;通电\;}}{\;}$2H20+02↑ | 分解反应 |
| B | 向烧碱溶液中通人CO2 | 2NaOH+C02═Na2C03+H20 | 复分解反应 |
| C | 溶洞的形成 | CaC03+H20+C02═Ca(HC03)2 | 化合反应 |
| D | 比较铜和银的活动性 | Cu+AgN03═Cu(NO3)2+Ag | 置换反应 |
| A. | A | B. | B | C. | C | D. | D |
4.下列各组物质能够在溶液中大量共存的是( )
| A. | HNO3、NaOH | B. | HCl、Na2CO3 | C. | NaCl、AgNO3 | D. | K2SO4、NaNO3 |
2.某实验小组的同学用氢氧化钠溶液和硫酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液加入稀硫酸一会后,实验中未观察到明显现象.他们停止滴加稀硫酸,并对烧杯内溶液中的溶质成分进行探究.
(1)写出该中和反应的化学方程式:H2SO4+2NaOH═Na2SO4+2H2O;
【提出问题】该烧杯内溶液中的溶质是什么.
【猜想】猜想Ⅰ:有Na2SO4和NaOH;
猜想Ⅱ:有Na2SO4和H2SO4;
猜想Ⅲ:Na2SO4;
【查阅资料】①BaCl2、Na2SO4溶液显中性,且Ba2+有毒.
【实验探究】小组同学取烧杯中的溶液少量于试管中,进行如下两个方案的探究.
[得出结论】(1)为什么会出现截然不同的结论呢?同学们经过检查,发现操作准确无误,讨论后同学一致认定猜想Ⅰ正确.另一结论错误的原因是Na2SO4+BaCl2═BaSO4↓+2NaCl.(用化学方程式表示)
【反思拓展】(1)实验结束了,小组同学将所有废液倒进废液缸,为了除去废液中的有害成分并将废液调至中性,应向废液缸中加入适量的稀硫酸.
(2)根据所学化学知识,验证烧杯内溶液中的溶质是否含有H2SO4,除以上方案外,单独使用某种试剂也能完成该实验,你选用的一种试剂是石蕊试液.
(1)写出该中和反应的化学方程式:H2SO4+2NaOH═Na2SO4+2H2O;
【提出问题】该烧杯内溶液中的溶质是什么.
【猜想】猜想Ⅰ:有Na2SO4和NaOH;
猜想Ⅱ:有Na2SO4和H2SO4;
猜想Ⅲ:Na2SO4;
【查阅资料】①BaCl2、Na2SO4溶液显中性,且Ba2+有毒.
【实验探究】小组同学取烧杯中的溶液少量于试管中,进行如下两个方案的探究.
| 实验方案 | 测溶液pH | 滴加过量BaCl2溶液 |
| 实验现象 | pH=10 | 产生白色沉淀 |
| 实验结论 | 溶液中有NaOH | 溶液中有H2SO4 |
【反思拓展】(1)实验结束了,小组同学将所有废液倒进废液缸,为了除去废液中的有害成分并将废液调至中性,应向废液缸中加入适量的稀硫酸.
(2)根据所学化学知识,验证烧杯内溶液中的溶质是否含有H2SO4,除以上方案外,单独使用某种试剂也能完成该实验,你选用的一种试剂是石蕊试液.
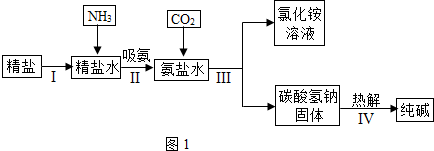
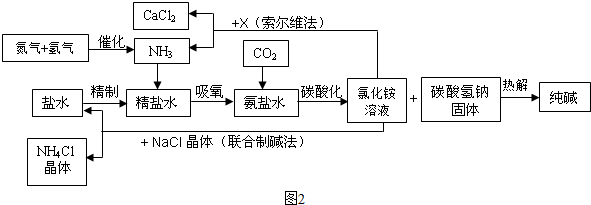


 A、B、C均为初中化学常见物质,它们之间的转化关系如图所示(反应条件,部分反应物和生成物已略去).
A、B、C均为初中化学常见物质,它们之间的转化关系如图所示(反应条件,部分反应物和生成物已略去).