题目内容
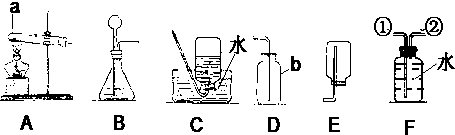
9. 化学兴趣小组利用如图装置探究气体制取的原理及性质,回答下列问题.
化学兴趣小组利用如图装置探究气体制取的原理及性质,回答下列问题.(1)制取氧气和探究燃烧条件
【步骤1】用装置A制取氧气,关闭K2,打开K1,将带火星木条放在B右侧的导管口,观察到带火星的木条复燃,说明氧气已收集满.请写出A装置中反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
【步骤2】关闭K1和K2,在C中放入几小粒白磷,加入热水,塞好胶塞,使导管口接近白磷,观察到热水中白磷不燃烧.
【步骤3】关闭K1,打开K2,C中有气泡冒出,白磷燃烧.对比步骤2可得燃烧需要的一个条件是氧气.
(2)研究二氧化碳的制取和性质
【步骤1】往B中加入适量澄清石灰水,C中加入一定量的水.
【步骤2】用装置A制取二氧化碳,打开K1和K2,观察到B中的现象是澄清石灰水变浑浊,写出B中反应的化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O.如果要证明二氧化碳能与水反应,则需要在C中滴加紫色石蕊试液(填指示剂名称).
分析 (1)【步骤1】根据氧气有助燃性,过氧化氢在二氧化锰的催化作用下制取氧气的反应物是固体和液体,反应条件是常温进行分析;
【步骤3】根据可燃物燃烧的条件进行分析;
(2)【步骤2】根据二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊变红色进行分析.
解答 解:(1)【步骤1】氧气有助燃性,所以关闭K2,打开K1,将带火星木条放在B右侧的导管口,观察到带火星的木条复燃,说明氧气已收集满,过氧化氢在二氧化锰的催化作用下制取氧气的反应物是固体和液体,反应条件是常温,过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
【步骤3】可燃物燃烧的条件是:温度达到着火点,氧气,所以关闭K1,打开K2,C中有气泡冒出,白磷燃烧,对比步骤2可得燃烧需要的一个条件是:氧气;
(2)【步骤2】二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以打开K1和K2,观察到B中的现象是:澄清石灰水变浑浊,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O,二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊变红色,所以要证明二氧化碳能与水反应,需要在C中滴加紫色石蕊试液.
故答案为:(1)【步骤1】带火星的木条复燃,2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
【步骤3】氧气;
(2)【步骤2】澄清石灰水变浑浊,Ca(OH)2+CO2=CaCO3↓+H2O,紫色石蕊试液.
点评 发生装置的选择要看反应物的状态和反应条件,收集装置的选择要看生成气体的密度和溶水性,是考题中常出现的问题,同学们一定要熟记;一些常见化学反应式的书写,同学们也一定要熟记于心.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | SiO2 | B. | Fe2O3 | C. | Al2O3 | D. | AlO |
①二氧化碳通入澄清石灰水后附在试管壁上的白色物质;
②氢氧化钠溶液滴入盛有氯化铁溶液的试管上附着的红褐色物质
③稀硫酸溶液滴入盛有硝酸钡溶液的试管上附着的白色物质
④碳酸钠溶液滴入盛有氯化钡溶液的试管上附着的白色物质.
| A. | ③④ | B. | ②③ | C. | ①③ | D. | ①④ |
 如图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子,a、b分别表示反应前和反应后的物质,下列说法不正确的是( )
如图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子,a、b分别表示反应前和反应后的物质,下列说法不正确的是( )| A. | a、b均属于混合物 | B. | 该反应属于置换反应 | ||
| C. | 该反应的生成物可能是氧化物 | D. | 该反应属于化合反应 |
| A. | 我们使用的铅笔笔芯不是金属铅制成的 | |
| B. | 温度计中的水银不是银,是金属汞 | |
| C. | 干冰不是冰,是固体二氧化碳 | |
| D. | 铝可以做容器,说明铝的化学性质稳定 |
| A. | 分子的大小发生了变化 | B. | 分子的运动速度发生变化 | ||
| C. | 分子之间的间隔发生了变化 | D. | 分子的质量发生了变化 |
| A. | 氢气加氧气等于水 | |
| B. | 氢气和氧气在点燃条件下反应生成水 | |
| C. | 两个氢分子加一个氧分子等于2个水分子 | |
| D. | 2g氢气和1g氧气反应生成2g水 |