题目内容
氮化铝(AlN)被广泛应用于集成电 路生产领域.在氮气(N2)流中由氧化铝与焦炭在高温条件下制得氮化铝:Al2O3+N2+3C
路生产领域.在氮气(N2)流中由氧化铝与焦炭在高温条件下制得氮化铝:Al2O3+N2+3C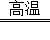 2AlN+3CO.若有14kg的氮气参加反应,可生成氮化铝的质量为多少?
2AlN+3CO.若有14kg的氮气参加反应,可生成氮化铝的质量为多少?
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算.
【分析】根据题意,由参加反应的氮气的质量,根据反应的化学方程式列式计算出生成氮化铝的质量即可.
【解答】解:设可生成氮化铝的质量为x.
Al2O3+N2+3C 2AlN+3CO
2AlN+3CO
28 82
14kg x
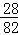 =
=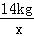 x=41kg
x=41kg
答:可生成氮化铝的质量为41kg.
【点评】本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
下列解决生活中实际问题的方法与相应科学原理不对应的是
| 选项 | 方法 | 科学原理 |
| A | 用酒精洗涤油污 | 油污能溶解在酒精中 |
| B | 醋除去热水瓶中的水垢 | 水垢能溶解在醋酸里 |
| C | 锅盖盖灭着火的油锅 | 温度降低到着火点以下 |
| D | 铝制容器不能盛酸性物质 | 酸性物质会破坏铝的氧化膜,进而腐蚀金属铝 |
加热条件下,在一个密闭的容器内有如下反应,反应过程中两次测得各物质的质量如下表所示,下列说法正确的是( )
| 物质 | P | Q | R | W |
| 第一次测得的质量/g | 40 | 4 | 3.6 | 4.8 |
| 第二次测得的质量/g | 待测 | 13 | 12.6 | 10.8 |
A.上述化学反应方程式一定为Q+R+W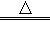 P
P
B.该反应R与W的质量变化之比为2:3
C.两次测定之间生成W的质量为10.8g
D.第二次测得P的质量为16g



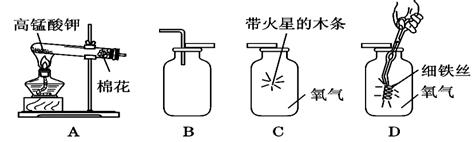
 B.
B. C.
C. D.
D.
 2CuO+X+CO2↑下列说法正确的是( )
2CuO+X+CO2↑下列说法正确的是( )