题目内容
1. 某化学实验小组用表面镀梓的铁皮进行实验探究,他们取一块镀锌铁皮,按如图所示进行实验.
某化学实验小组用表面镀梓的铁皮进行实验探究,他们取一块镀锌铁皮,按如图所示进行实验.【提出问题】反应后所得的无色滤液a的溶质与固体b的成分分别是什么?
【猜想假设】无色滤液a的溶质是:猜想①ZnCl2;猜想②ZnCl2、FeCl2;猜想③ZnCl2、HCl.
【反思评价】思成同学认为猜想②不成立,他的理由是FeCl2溶液呈浅绿色;思远同学认为猜想③也不成立,他的理由是溶液为无色,说明铁有剩余,故溶液中不可能存在稀盐酸.
【推理判断】由无色滤液a的成分可推知,固体b中还可能含有锌.
【实验与结论】为验证固体b的成分,思哲同学向固体b的样品中加入少量(填化学式)FeCl2(或FeSO4)溶液,浅绿色溶液褪为无色,说明固体b含有铁和锌.
【表达交流】(1)上述实验还可以得出这两种金属的活动性顺序为Zn>Fe.
(2)思琪同学认为向固体b中滴加足量的稀盐酸,若观察到(填序号)④,也能确定出固体b中含有铁和锌.
①无明显变化 ②有气泡产生且溶液始终不变色
③有气泡产生且溶液立刻变为浅绿色 ④有气泡产生且溶液开始没有变为浅绿色
【拓展延伸】镀锌铁皮开始与稀盐酸反应没有马上产生气泡的现象,结合锌、铁的活动性,说明在铁的表面镀锌可阻止铁进一步氧化的原因是常温下在空气中锌的表面易生成一层致密的氧化膜.
分析 【猜想假设】
锌和稀盐酸反应生成氯化锌和氢气;
【反思评价】
铁和稀盐酸反应生成氯化亚铁和氢气,氯化亚铁溶液是浅绿色溶液;
【实验与结论】由无色滤液a 的成分可推知,固体b中一定含有的物质;锌比铁活泼,能和硫酸亚铁反应生成硫酸锌和铁;
【拓展延伸】
通常情况下,锌能够被空气中的氧气氧化成一层致密的氧化物保护膜.
解答 解:【猜想假设】
无色滤液a的溶质是:猜想①氯化锌;猜想②ZnCl2、FeCl2;猜想③ZnCl2、HCl.
【反思评价】
思成同学认为猜想②不成立,他的理由是:因为滤液a无色,说明溶质中不可能含有氯化亚铁,FeCl2溶液呈浅绿色;思远同学认为猜想③也不成立,他的理由是因为滤液a无色,说明溶质中不可能含有氯化亚铁,进一步说明铁未参加反应,又因为铁与盐酸能反应,所以盐酸不能剩余,即溶质中也不可能有氯化氢.
【实验与结论】由无色滤液a 的成分可推知,固体b中一定含有铁.
为验证固体b的成分,单杰向b的样品中加入一种有色物质FeSO4溶液,产生的现象是溶液由浅绿色变为无色,据此现象,证明出固体b中的两种成分,同时得出这两种金属的活动性顺序.
【表达交流】
(1)上述实验还可以得出这两种金属的活动性顺序为Zn>Fe.
(2)思琪同学认为向固体b中滴加足量的稀盐酸,若观察到有气泡产生且溶液开始没有变为浅绿色也能确定出固体b中含有铁和锌.
【拓展延伸】通过比较锌、铁的活动性,结合图象B在开始加入稀盐酸的过程中并没有产生氢气的现象,你认为在铁的表面镀锌的原因是常温下,锌在空气中表面生成一层薄而致密的保护膜,可阻止进一步氧化.
答案:
【猜想假设】猜想①ZnCl2
【反思评价】FeCl2溶液呈浅绿色;溶液为无色,说明铁有剩余,故溶液中不可能存在稀盐酸
【进行实验】FeCl2(或FeSO4)
【表达交流】(1)>
(2)④
【拓展延伸】(2分)常温下在空气中锌的表面易生成一层致密的氧化膜
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

| A. | 溶液一定是混合物 | B. | 溶剂一定是水 | ||
| C. | 溶质一定是固体 | D. | 溶液一定是无色 |
| 物质 | 杂质 | 除去杂质的方法 | |
| A | NaCl | 泥沙 | 溶解、过滤、蒸发 |
| B | N2 | O2 | 通过灼热的铜网 |
| C | NaOH溶液 | Na2CO3 | 加入稀盐酸至不再产生气泡 |
| D | CO | CO2 | 先通过足量的氢氧化钠溶液,再通过浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  配制氯化钠溶液 | B. |  闻气体气味 | C. |  检查装置气密性 | D. |  称量固体质量 |
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 固体A | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| 固体B | 13.3 | 31.6 | 63.9 | 110 | 169 | |
| 固体C | 35.0 | 44.5 | 57.6 | 55.0 | 50.0 |
(2)将80℃时A、B、C三种物质的饱和溶液降温到60℃,其中溶质质量分数不变的物质是C.
(3)精制A时,通常采用的是蒸发溶剂的方法而不用降低溶液温度的方法,请据表分析,其原因是A的溶解度受温度影响不大.
(4)20℃时,溶解3.5g的固体C,蒸馏水的最佳使用量约为10ml.
| A. | 冬天用煤炉取暖,为防止热量散失,应关紧门窗 | |
| B. | 进入干涸的深井前,应先做灯火试验 | |
| C. | 用NaHCO3治疗胃酸过多 | |
| D. | 铵态氮肥与熟石灰混合使用会降低肥效 |
 为了测定某石灰石样品中碳酸钙的质量分数,化学兴趣小组的同学秤取石灰石样品12.5g放入烧杯中,逐渐加入稀盐酸(杂质不溶于水,也不与盐酸反应),测得产生气体与加入稀盐酸的质量关系如图所示:
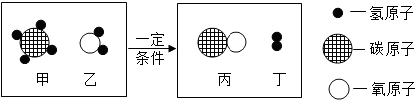
为了测定某石灰石样品中碳酸钙的质量分数,化学兴趣小组的同学秤取石灰石样品12.5g放入烧杯中,逐渐加入稀盐酸(杂质不溶于水,也不与盐酸反应),测得产生气体与加入稀盐酸的质量关系如图所示: 如图是某反应的微观过程.
如图是某反应的微观过程.