题目内容
同学们在实验室进行“粗盐中难溶性杂质的去除”实验.以下是小丽同学的实验报告部分内容.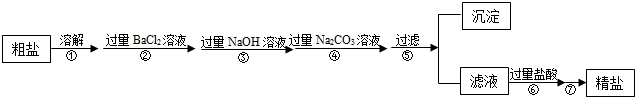
【实验目的】粗盐中难溶性杂质的去除
【实验过程】
①用托盘天平称取5.0g粗盐,并全部加入到盛有10mL水的烧杯里,边加边用玻璃棒搅拌;
②过滤食盐水,观察滤液无色透明;
③将所得澄清滤液倒入蒸发皿,加热,并用玻璃棒不断搅拌,当液体蒸干时,停止加热;
④用玻璃棒把固体转移到纸上,称量,计算所得精盐的产率.
【实验分析】
(1)步骤①中因为 ,导致实验后精盐产率比其他同学偏低.
(2)步骤③中出现的错误操作是 该操作中玻璃棒的作用 .
【实验反思】经过这样操作所得到的精盐是纯净物吗?
【查阅资料】粗盐中含有可溶性杂质(MgCl2、CaCl2、Na2SO4等)和不溶性杂质(泥沙等).
【实验设计】
①步骤⑦的操作名称为 .
②步骤⑥中加入过量盐酸的目的是 .
③步骤②和步骤④不可以颠倒的原因是 .
④检验步骤④中Na2CO3溶液已过量的方法是 .
【实验结论】除去难溶性杂质得到的精盐不是纯净物.
【思维拓展】配制好的盐酸溶液的标签,请根据标签上的文字信息,进行计算:

(1)该盐酸溶液中溶剂质量为 g;
(2)某碳酸钠样品中含有少量氯化钠.为测定样品中碳酸钠的质量分数,现称取该样品11g,放入烧杯中加水完全溶解后滴加上述配制的盐酸溶液至完全反应,最后测得生成气体的质量为4.4g.计算:①样品中碳酸钠的质量分数(结果精确到0.1%)
②用去盐酸溶液的质量是多少g?

【实验目的】粗盐中难溶性杂质的去除
【实验过程】
①用托盘天平称取5.0g粗盐,并全部加入到盛有10mL水的烧杯里,边加边用玻璃棒搅拌;
②过滤食盐水,观察滤液无色透明;
③将所得澄清滤液倒入蒸发皿,加热,并用玻璃棒不断搅拌,当液体蒸干时,停止加热;
④用玻璃棒把固体转移到纸上,称量,计算所得精盐的产率.
【实验分析】
(1)步骤①中因为
(2)步骤③中出现的错误操作是
【实验反思】经过这样操作所得到的精盐是纯净物吗?
【查阅资料】粗盐中含有可溶性杂质(MgCl2、CaCl2、Na2SO4等)和不溶性杂质(泥沙等).
【实验设计】
①步骤⑦的操作名称为
②步骤⑥中加入过量盐酸的目的是
③步骤②和步骤④不可以颠倒的原因是
④检验步骤④中Na2CO3溶液已过量的方法是
【实验结论】除去难溶性杂质得到的精盐不是纯净物.
【思维拓展】配制好的盐酸溶液的标签,请根据标签上的文字信息,进行计算:

(1)该盐酸溶液中溶剂质量为
(2)某碳酸钠样品中含有少量氯化钠.为测定样品中碳酸钠的质量分数,现称取该样品11g,放入烧杯中加水完全溶解后滴加上述配制的盐酸溶液至完全反应,最后测得生成气体的质量为4.4g.计算:①样品中碳酸钠的质量分数(结果精确到0.1%)
②用去盐酸溶液的质量是多少g?
考点:氯化钠与粗盐提纯,酸的化学性质,碱的化学性质,盐的化学性质,根据化学反应方程式的计算
专题:常见的盐 化学肥料
分析:【实验分析】(1)根据食盐的溶解能力进行判断;
(2)根据蒸发的注意事项进行解答;
【实验设计】①根据蒸发时注意事项考虑;②加入过量盐酸是将前边加入的过量的氢氧化钠和碳酸钠反应;③根据加入的碳酸钠有两个作用,除去氯化钙和过量的氯化钡考虑;④取上层清液于试管中,滴加氯化钙溶液,如果出现白色沉淀,说明碳酸钠溶液已经过量
【思维拓展】(1)根据溶液质量×溶质质量分数=溶质质量,再用溶液质量-溶质质量=溶剂质量;(2)根据生成的二氧化碳的质量计算出碳酸钠的质量,再根据碳酸钠的质量除以样品的质量即可,根据二氧化碳质量直接计算消耗盐酸的质量.
(2)根据蒸发的注意事项进行解答;
【实验设计】①根据蒸发时注意事项考虑;②加入过量盐酸是将前边加入的过量的氢氧化钠和碳酸钠反应;③根据加入的碳酸钠有两个作用,除去氯化钙和过量的氯化钡考虑;④取上层清液于试管中,滴加氯化钙溶液,如果出现白色沉淀,说明碳酸钠溶液已经过量
【思维拓展】(1)根据溶液质量×溶质质量分数=溶质质量,再用溶液质量-溶质质量=溶剂质量;(2)根据生成的二氧化碳的质量计算出碳酸钠的质量,再根据碳酸钠的质量除以样品的质量即可,根据二氧化碳质量直接计算消耗盐酸的质量.
解答:解:【实验分析】(1)将5.0g粗盐全部加入10mL水中,其中的氯化钠可能不能全部溶解,所以得出的产率偏低;
(2)对液体进行蒸发时当蒸发皿中出现大量固体时就应该停止加热,让蒸发皿的余热来蒸干液体,否则会导致固体飞溅,在该操作中玻璃杯的作用是搅拌使液体受热均匀,防止因局部温度过高,造成液滴飞溅;
【实验设计】①氯化钠溶液蒸发结晶得到精盐;
②加入过量盐酸是将前边加入的过量的氢氧化钠和碳酸钠反应掉.
③加入的碳酸钠有两个作用,除去氯化钙和过量的氯化钡,所以位置不能颠倒,否则不能将过量的氯化钡除掉;
④由于碳酸钠与氯化钙反应生成碳酸钙沉淀,所以取上层清液于试管中,滴加氯化钙溶液,如果出现白色沉淀,说明碳酸钠溶液已经过量;
【思维拓展】(1)溶质质量=100g×10%=10g,所以溶剂质量=100g-10g=90g;
(2)设碳酸钠的质量为x,消耗掉的盐酸溶液的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x y×10% 4.4g
根据
=
解得x=10.6g
根据
=
解得y=73g
纯碱样品中碳酸钠的质量分数为
×100%=96.4%
答:①纯碱样品中碳酸钠的质量分数为96.4%②用去盐酸溶液的质量是为73g
故答案为:【实验分析】(1)5.0g粗盐全部加入10mL水中,其中的氯化钠可能不能全部溶解;(2)不能当液体蒸干时再停止加热;防止因局部温度过高,造成液滴飞溅;
【实验设计】①蒸发结晶;②除去过量的氢氧化钠和碳酸钠;③无法除去过量的氯化钡;④取上层清液于试管中,滴加氯化钙溶液,如果出现白色沉淀,说明碳酸钠溶液已经过量;
【思维拓展】(1)90;(2)①96.4%②73g.
(2)对液体进行蒸发时当蒸发皿中出现大量固体时就应该停止加热,让蒸发皿的余热来蒸干液体,否则会导致固体飞溅,在该操作中玻璃杯的作用是搅拌使液体受热均匀,防止因局部温度过高,造成液滴飞溅;
【实验设计】①氯化钠溶液蒸发结晶得到精盐;
②加入过量盐酸是将前边加入的过量的氢氧化钠和碳酸钠反应掉.
③加入的碳酸钠有两个作用,除去氯化钙和过量的氯化钡,所以位置不能颠倒,否则不能将过量的氯化钡除掉;
④由于碳酸钠与氯化钙反应生成碳酸钙沉淀,所以取上层清液于试管中,滴加氯化钙溶液,如果出现白色沉淀,说明碳酸钠溶液已经过量;
【思维拓展】(1)溶质质量=100g×10%=10g,所以溶剂质量=100g-10g=90g;
(2)设碳酸钠的质量为x,消耗掉的盐酸溶液的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x y×10% 4.4g
根据
| 106 |
| 44 |
| x |
| 4.4g |
根据
| 73 |
| 44 |
| y×10% |
| 4.4g |
纯碱样品中碳酸钠的质量分数为
| 10.6g |
| 11g |
答:①纯碱样品中碳酸钠的质量分数为96.4%②用去盐酸溶液的质量是为73g
故答案为:【实验分析】(1)5.0g粗盐全部加入10mL水中,其中的氯化钠可能不能全部溶解;(2)不能当液体蒸干时再停止加热;防止因局部温度过高,造成液滴飞溅;
【实验设计】①蒸发结晶;②除去过量的氢氧化钠和碳酸钠;③无法除去过量的氯化钡;④取上层清液于试管中,滴加氯化钙溶液,如果出现白色沉淀,说明碳酸钠溶液已经过量;
【思维拓展】(1)90;(2)①96.4%②73g.
点评:要想解答好这类题目,首先,要理解和熟记氯化钠与粗盐提纯等相关知识.然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
5.6g含杂质(假设含有一种杂质)的铁粉和足量的稀硫酸反应,生成0.18g H2,则在铁粉中含有的杂质不可能是( )
| A、Mg | B、Al | C、Cu | D、Zn |

 如图是探究酒精灯灯焰结构及性质的实验示意图:
如图是探究酒精灯灯焰结构及性质的实验示意图: