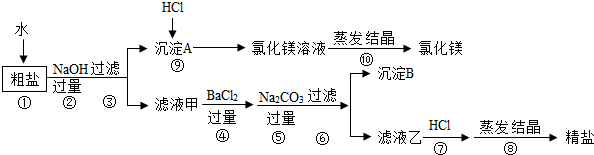
题目内容
18.取干燥的氯酸钾与二氧化锰的混合物31克,加热制取氧气.待反应完全后,得固体物质21.4克(氧气密度为1.43g/L);计算:(1)反应生成多少克氧气?体积为多少升;
(2)原混合物中有多少克氯酸钾?
分析 (1)根据质量守恒定律,混合物减少的质量就是生成的氧气的质量,再有氧气的质量和密度求出体积.
(2)根据氯酸钾和二氧化锰制取氧气的反应的方程式,由氧气的质量可求出氯化钾的质量,由此求出二氧化锰的质量.
解答 解:(1)由题意可知,生成氧气的质量即反应前后固体物质的质量差为:31g-21.4g=9.6g,
氧气的体积为:$\frac{9.6g}{1.43g/L}$≈6.71L
(2)设原混合物中氯酸钾的质量为x,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 96
x 9.6g
$\frac{245}{96}=\frac{x}{9.6g}$ 解得:x=24.5g
答:(1)反应生成9.6克氧气,体积为6.71升;(2)原混合物中有24.5克氯酸钾.
点评 解答本题的关键是要分析出试管内质量的减少量就是生成的氧气质量,再根据氧气质量结合化学方程式进一步计算.

练习册系列答案
相关题目
8.下列说法不正确的是( )
| A. | 分子是保持物质化学性质的最小粒子 | |
| B. | 原子是最小粒子 | |
| C. | 离子可以参加化学反应 | |
| D. | 原子、分子和离子都能构成物质 |
9.能证明木炭、金刚石、石墨都含有碳元素的方法是( )
| A. | 分别置于氧气中燃烧,都能得到一种产物CO2 | |
| B. | 观察它们的颜色来判断 | |
| C. | 测定三种物质的密度来判断 | |
| D. | 测定它们的硬度来判断 |
13.根据图某反应微观示意图判断下列说法正确的是( )
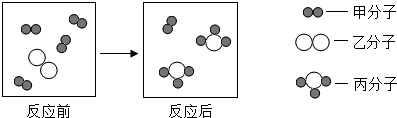

| A. | 参加反应的甲和乙分子个数比为4:1 | |
| B. | 该反应属于置换反应 | |
| C. | 反应前后原子的种类、数目都不变 | |
| D. | 反应前后各种元素的化合价都不变 |
8.逻辑推理是化学学习常用的思维方法.下列观点正确的是( )
| A. | 酸的溶液pH值小于7,碱的溶液pH大于7,所以盐的溶液pH值一定等于7 | |
| B. | 在同一化合物中,金属元素显正价,所以非金属元素一定显负价 | |
| C. | 氧化物只含有两种元素,所以氧化物中一定有一种元素不是氧元素 | |
| D. | 酸碱中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 |