题目内容
6.化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属,流程如图:(未做特别说明的“固体”,可能为纯净物或混合物)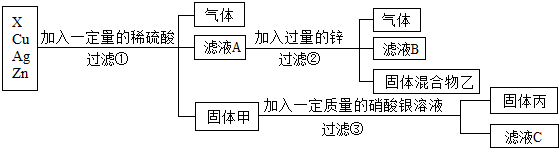
(1)四种金属的活动性由强到弱的顺序是Zn>X>Cu>Ag;
(2)过滤操作中用到的玻璃仪器有烧杯、漏斗和玻璃棒;
(3)滤液A中共有三种溶质,固体丙中一定含有的金属是银.
分析 根据金属能与酸反应的排在氢前面,不能与酸反应的排在氢的后面,活泼的金属能把不活泼的金属从盐溶液中置换出来分析金属活动性的顺序及反应过程中发生的反应并分析溶液中的成分.
解答 解:根据金属的活泼性顺序:锌>氢>铜>银,故向锌、X、铜、银的金属混合物中加入稀硫酸,锌一定参加反应产生气泡,而铜和银一定没反应,得到的滤液A再加入过量的锌得到混合物乙和滤液B,说明锌除了和过量的硫酸反应产生气体外,还和盐溶液发生了置换反应,因此说明锌的活动性比X强,且X位于氢前;由于硫酸过量,固体甲含有铜和银,铜和硝酸银反应产生硝酸铜和银.因此:
(1)四种金属的活动性顺序由强到弱的是:Zn>X>Cu>Ag;
(2)过滤操作中用到的玻璃仪器有烧杯、漏斗和玻璃棒;
(3)由上述分析可知,滤液A一定有硫酸锌、剩余的硫酸和x的硫酸盐三种溶质;③中是铜和硝酸银反应生成了硝酸铜和银,所以一定有的金属是银,
故答案为:
(1)Zn>X>Cu>Ag;(2)玻璃棒;(3)3;Ag
点评 此题以实验设计流程的形式让学生去利用金属活动性顺序表解决有关金属化学性质的问题,有一定的难度,解题的关键是熟练运用金属活动性的顺序意义.

练习册系列答案
相关题目
14.下列物质的变化,属于物理变化的是( )
| A. | 木材燃烧 | B. | 铁矿石冶炼成铁 | C. | 铁矿石粉碎 | D. | 铁钉生锈 |
2.下列实验设计或操作,能达到实验目的是( )
| A. |  干燥二氧化碳 | |
| B. |  检验浓盐酸挥发出“白雾”中含有氢离子 | |
| C. |  检验X溶液中是否含有SO42- | |
| D. |  用氯化钡溶液鉴别稀硫酸和稀盐酸 |
3.食品包装袋上常有“开袋后请尽快食用”,其原因不可能是( )
| A. | 防止食品吸水变潮 | B. | 防止食品失水风干 | ||
| C. | 防止食品因缓慢氧化而变质 | D. | 防止食品与氮气发生反应 |



 某研究小组利用比较方法,探究二氧化硫和二氧化碳是否具有一些相似的化学性质.该小组同学进行了如下探究:
某研究小组利用比较方法,探究二氧化硫和二氧化碳是否具有一些相似的化学性质.该小组同学进行了如下探究: