题目内容
课本中有一问:为什么汗水有咸味?学习小组同学为此开展探究.
提出问题;汗水中产生咸味的物质是什么?
假设与猜想:根据生活经验推测,汗水中产生咸味的物质可能是 .
查阅资料:用铂丝醮取少许含有钠元素的溶液(或物质)在酒精灯火焰上灼烧,会呈现黄色火焰.
制订计划:为了证明咸味物质是猜想中的物质,一是要证明汗水溶液中含有阴离子 (填写离子符号),二是要证明汗水溶液中有阳离子 (填写离子符号).
进行实验:
证明阴离子的实验:向汗水溶液中滴加 溶液,再加入少量稀硝酸,振荡,仍有白色沉淀产生.
证明阳离子的实验: .
结论:经上述实验证明,汗水中的咸味物质就是猜想中的物质.
分析与交流:上述实验中,证明阴离子存在的化学反应方程式为: ,该反应属于复分解反应.
假设与猜想:氯化钠. 制订计划:Cl﹣;Na+.
进行实验:硝酸银 用铂丝醮取少许汗水溶液,在酒精灯火焰上灼烧,呈现黄色火焰.
分析与交流:NaCl+AgNO3═NaNO3+AgCl↓.
解析试题分析:假设与猜想:
根据生活经验推测,汗水中产生咸味的物质可能是氯化钠.
故填:氯化钠.
制订计划:
为了证明咸味物质是猜想中的物质,一是要证明汗水溶液中含有阴离子——氯离子,氯离子的符号是Cl﹣,二是要证明汗水溶液中有阳离子——钠离子,钠离子的符号是Na+.
故填:Cl﹣;Na+.
进行实验:
证明阴离子的实验:向汗水溶液中滴加硝酸银溶液,再加入少量稀硝酸,振荡,仍有白色沉淀产生.
故填:硝酸银.
证明阳离子的实验:用铂丝醮取少许汗水溶液,在酒精灯火焰上灼烧,呈现黄色火焰.
故填:用铂丝醮取少许汗水溶液,在酒精灯火焰上灼烧,呈现黄色火焰.
分析与交流:
证明阴离子存在的反应是:氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,反应的化学反应方程式为:NaCl+AgNO3═NaNO3+AgCl↓,该反应属于复分解反应.
故填:NaCl+AgNO3═NaNO3+AgCl↓.
考点:实验探究物质的组成成分以及含量;氯化钠与粗盐提纯;常见离子的检验方法及现象;书写化学方程式、文字表达式、电离方程式.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案某小组同学用盐酸和氢氧化钙,对酸和碱的中和反应进行探究.请你参与.
甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象.结论:两种物质未发生反应.
乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由 色变为无色.结论:两种物质发生了反应.反应的化学方程式为 .
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应.并对甲的实验继续探究.
[提出问题]甲实验后的溶液中有什么溶质?
[作出猜想]猜想一,只有CaCl2;猜想二有CaCl2和Ca(OH)2;猜想三,有CaCl2和HCl.
[实验探究]为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验.
| 方案编号 | 方案1 | 方案2 | 方案3 |
| 实验操作(分别取少量甲实验后的溶液于试管中) |  | 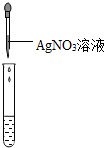 |  |
| 实验现象 | 对比标准比色卡:pH<7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有HCl | 溶液中有CaCl2 |
[实验评价]丙的实验操作和方案中有不足之处,其不足之处是 .
大家讨论后通过方案3即证明了猜想三正确,其实验中应观察到的现象为 .
[实验拓展]为节约资源和避免实验废液对环境污染,小组同学将方案1和方案3及甲实验后烧杯中剩余溶液混合(混合时未见明显现象),并对混合液中的盐分离回收,请将相关内容填入下表.
| 要分离的盐 | 所用试剂 | 主要操作 |
| | | |
化学小组同学探究“酸的化学性质”,请你参与并完成下列部分实验内容.
| 实验过程 | 实验现象 | 实验结论 |
 | ①号试管:固体溶解,产生气泡,放热; ②号试管: . | a、金属活动性: 镁 铜(填“>”或“<”) b、涉及到的化学方程式 . |
(2) | ③号试管:绿色粉末逐渐溶解,产生气泡,溶液显蓝色. ④号试管:绿色粉末逐渐溶解,产生气泡,溶液显绿色. | Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑ Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑ |
【发现问题】碱式碳酸铜与稀硫酸反应形成的CuSO4溶液显蓝色,而与盐酸反应形成的CuCl2溶液显绿色.
【提出问题】同样都含有Cu2+,为什么③号试管中的CuSO4溶液显蓝色,而④号试管中的CuCl2溶液显绿色.
【猜想与假设】猜想一:若溶液中Cu2+显蓝色,则SO42+对Cu2+显色无影响,而Cl﹣对Cu2+显色有影响;
猜想二:若溶液中Cu2+显绿色,则 ;
猜想三:…
【实验验证】同学们用下列两种不同方案初步验证猜想一,请你补全实验所需试剂:
方案一:取少量③号试管中的溶液于另一支试管中,向其中加入 ,观察到预期实验现象,猜想一正确.
方案二:取少量④号试管中的CuCl2溶液于另一支试管中,向其中加入 ,观察到预期实验现象,猜想一正确.
【评价与反思】同学们在实验探究的过程中,体会到了溶液颜色成因复杂,相关知识还有待进一步学习.
某肉联厂在鲜肉表面涂抹白色粉末A以延长保质时间。小新进行了如下实验,探究化合物A的化学组成。
【定性研究】
| 步骤 | 实验操作 | 实验现象 |
| ① | 取样于试管中,加足量蒸馏水,振荡 | 样品消失,得到无色澄清溶液 |
| ② | 向步骤①所得溶液中滴加无色酚酞试液 | 溶液变红 |
| ③ | 向步骤②所得溶液中滴加稀盐酸至过量 | 产生无色无气味气体,溶液褪色 |
根据上述实验可初步推知,A是 ;
【定量研究】
为进一步探究A的化学组成,进行如下化学实验:
①将盛有292g质量分数为12.5%的稀盐酸的装置置于电子天平上(该装置可确保氯化氢和水蒸气不逸出);
②向装置中加入2.0gA,在天平读数不再变化时记录数据;
③重复②若干次日
④以mA(加入A的质量)为横坐标,以△m(溶液的增重)为纵坐标,绘得图。

通过计算回答下列问题:
(1)实验中反应生成的气体的总质量为 g;
(2)A中阳离子与阴离子质量的最简整数比为 ;
(3)A的化学式为 。





