题目内容
为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中都加入了11 g样品及足量的水配成溶液;②向三个 烧杯中加入质量不等的CaCl2粉末;③将充分反应后生成的沉淀过滤、洗涤、干燥得到w g的白色固体。实验数据如下:
烧杯中加入质量不等的CaCl2粉末;③将充分反应后生成的沉淀过滤、洗涤、干燥得到w g的白色固体。实验数据如下:
| 烧杯 | 烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ |
| 加入CaCl2的质量/g | 5.55 | 12 | 15 |
| w/g | 5 | 10 | 10 |
回答下列问题:
(6) 将过滤后的烧杯Ⅲ中的溶液蒸干,可得到 g固体,该固体由 和 组成(后两空填化学式)。
(7) 样品中碳酸钠的质量分数是多少?
解:(1)根据表中数据,11 g样品中最多生成10 g碳酸钙,设11 g样品中碳酸钠的质量为x,消耗的氯化钙的质量为y,反应生成的氯化钠的质量为z,则
Na2CO3+CaCl2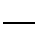 CaCO3↓+2NaCl
CaCO3↓+2NaCl
106 111 100 117
x y 10 g z
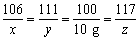 ,解得x=10.6 g,y=11.1 g,z=11.7 g
,解得x=10.6 g,y=11.1 g,z=11.7 g
则11 g样品中NaCl为11 g-10.6 g=0.4 g
烧杯Ⅲ中剩余的CaCl2为15 g-11.1 g=3.9 g
生成的NaCl为11.7 g
所以将过滤后的烧杯Ⅲ中的溶液蒸干,得到NaCl和CaCl2质量为0.4 g+3.9 g+11.7 g=16 g
故答案为:16,NaCl,CaCl2。
(2)样品中碳酸钠的质量分数为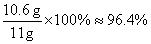
答:样品中碳酸钠的质量分数约为96.4%。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案通过海水晾晒可得粗盐。粗盐除含有NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如下图所示。
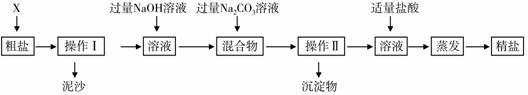
[提示:MgCl2+2NaOH Mg(OH)2↓+2NaCl;CaCl2+Na2CO3
Mg(OH)2↓+2NaCl;CaCl2+Na2CO3
 CaCO3↓+2NaCl]
CaCO3↓+2NaCl]
根据以上信息回答:
(1) 在完成操作Ⅰ之前,必须加入的X物质是________。
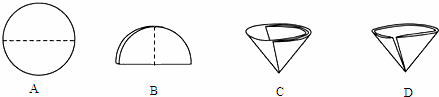
(2) 操作Ⅰ和操作Ⅱ的名称是_________;操作中玻璃棒的作用是____________;该操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是______(选填字母序号)。
(3) 在蒸发操作中容易造成食盐固体飞溅,为尽量减少飞溅,可采取 等措施(选填字母序号)。
| A.玻璃 | B.来回移动酒精灯加热 | C.来回移动蒸发皿加热 |
(4) 在实验过程中加入过量的Na2CO3溶液,其实验目的是________ _____________。
(5) 判断加入的盐酸“适量”的方法是_______ _____ ______________________。
(6) 实验所得精盐的质量大于粗盐中NaCl的质量,原因是  _________________________________________________。
_________________________________________________。
下列鉴别两种不同物质的方法中不正确的是( )
| 序号 | 待鉴别的物质 | 鉴别方法 |
| A | 氮气与二氧化碳 | 点燃的木条 |
| B | 氧化钙与硝酸铵 | 加水,测量溶液温度的变化 |
| C | 尿素和硫酸铵 | 加熟石灰,研磨 |
| D | 氧化铜与铁粉 | 用磁铁吸引 |
一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表,有关说法正确的是
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 2 | 8 | 30 | 50 |
| 反应后质量/g | 20 | 待测 | 46 | 16 |
A. 该反应类型为化合反应 B. 待测值为0
C. 反应中甲和丙的质量比为9﹕8 D. 乙一定是该反应的催化剂[来源:学.科.网]
 棒不断搅拌
棒不断搅拌 无色酚酞溶液 C PH试纸
无色酚酞溶液 C PH试纸 
 _________________。
_________________。 C. 葡萄酒 D. 岩石
C. 葡萄酒 D. 岩石 产生的两步反应为A+C→AC;B+AC→A+BC,接照上述理论推断该反应物的催化剂是 ( )
产生的两步反应为A+C→AC;B+AC→A+BC,接照上述理论推断该反应物的催化剂是 ( )