题目内容
通过海水晾晒可得粗盐。粗盐除含有NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如下图所示。
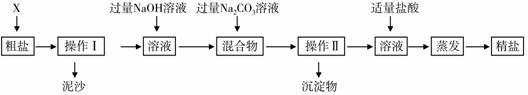
[提示:MgCl2+2NaOH Mg(OH)2↓+2NaCl;CaCl2+Na2CO3
Mg(OH)2↓+2NaCl;CaCl2+Na2CO3
 CaCO3↓+2NaCl]
CaCO3↓+2NaCl]
根据以上信息回答:
(1) 在完成操作Ⅰ之前,必须加入的X物质是________。
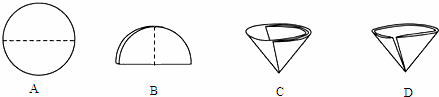
(2) 操作Ⅰ和操作Ⅱ的名称是_________;操作中玻璃棒的作用是____________;该操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是______(选填字母序号)。
(3) 在蒸发操作中容易造成食盐固体飞溅,为尽量减少飞溅,可采取 等措施(选填字母序号)。
| A.玻璃 | B.来回移动酒精灯加热 | C.来回移动蒸发皿加热 |
(4) 在实验过程中加入过量的Na2CO3溶液,其实验目的是________ _____________。
(5) 判断加入的盐酸“适量”的方法是_______ _____ ______________________。
(6) 实验所得精盐的质量大于粗盐中NaCl的质量,原因是  _________________________________________________。
_________________________________________________。
(1)水 (2)过滤 引流 D (3)ABC (4)除尽溶液中的钙离子
(5)滴加盐酸至无气泡放出为止 (6)在粗盐提纯的过程中有NaCl生成

为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中都加入了11 g样品及足量的水配成溶液;②向三个 烧杯中加入质量不等的CaCl2粉末;③将充分反应后生成的沉淀过滤、洗涤、干燥得到w g的白色固体。实验数据如下:
烧杯中加入质量不等的CaCl2粉末;③将充分反应后生成的沉淀过滤、洗涤、干燥得到w g的白色固体。实验数据如下:
| 烧杯 | 烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ |
| 加入CaCl2的质量/g | 5.55 | 12 | 15 |
| w/g | 5 | 10 | 10 |
回答下列问题:
(6) 将过滤后的烧杯Ⅲ中的溶液蒸干,可得到 g固体,该固体由 和 组成(后两空填化学式)。
(7) 样品中碳酸钠的质量分数是多少?
 棒不断搅拌
棒不断搅拌 时若发生泄漏,可“喷射氢氧化钠溶液与H2S发生中和反应,该反应的化学方程式为 。
时若发生泄漏,可“喷射氢氧化钠溶液与H2S发生中和反应,该反应的化学方程式为 。
 苯酚是医院常用的消毒剂,
苯酚是医院常用的消毒剂,
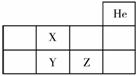 如图为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断中, 不正确(选填选项字母)。
如图为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断中, 不正确(选填选项字母)。