题目内容
4. 化学兴趣小组对某种粗锌(主要成分为锌,杂质不与酸反应)样品中锌的含量进行了测定,如图所示,称20g该粗锌样品置于烧杯(质量为58.8g)中,加入100g足量稀硫酸,待粗锌完全反应后,称得烧杯及烧杯中剩余物总重量为178.4g.
化学兴趣小组对某种粗锌(主要成分为锌,杂质不与酸反应)样品中锌的含量进行了测定,如图所示,称20g该粗锌样品置于烧杯(质量为58.8g)中,加入100g足量稀硫酸,待粗锌完全反应后,称得烧杯及烧杯中剩余物总重量为178.4g.(1)反应过程中产生氢气的质量为0.4 g.
(2)计算该粗锌样品中锌的质量分数.
分析 锌能与稀硫酸反应生成氢气,而杂质不能,故依据反应前后物质的质量之差可求生成的氢气质量;依据氢气的质量利用化学方程式可求混合物中锌的质量,进而可求样品中锌的质量分数;
解答 解:(1)反应过程中产生氢气的质量为:100g+20g+58.8g-178.4g=0.4g;
故填:0.4;
(2)解:设锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4 g
$\frac{65}{2}=\frac{x}{0.4g}$
x=13g
锌的质量分数=$\frac{13g}{20g}$=65%
答:锌的质量分数为65%.
点评 利用质量守恒定律求出反应放出氢气的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.

练习册系列答案
相关题目
19.在CO和CO2的混合气体中,碳元素的质量分数是36%,将该气体10g通过足量灼热的CuO粉末,完全反应,气体通入足量的澄清石灰水中,得到白色沉淀的质量是( )
| A. | 10g | B. | 13.4g | C. | 20g | D. | 30g |
16.如图是电解水的简易实验装置示意图,下列有关叙述错误的是( )
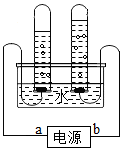

| A. | a、b分别是电源的负极、正极 | |
| B. | 在水中加入少许氢氧化钠,可以增强导电性 | |
| C. | 左边试管中收集到的气体能使带火星木条复燃 | |
| D. | 电解水实验说明,水是由氢元素和氧元素组成的 |
13.下列实验现象描述正确的是( )
| A. | 镁与足量稀盐酸反应放热,有气泡产生,固体消失 | |
| B. | 硫在氧气中燃烧,发出蓝紫色火焰,生成二氧化硫 | |
| C. | 稀盐酸中滴入酚酞试液,溶液变为红色 | |
| D. | 红磷在空气中燃烧,产生大量白色烟雾 |
14.下列元素中,为金属元素的是( )
| A. | 锡 | B. | 碘 | C. | 氧 | D. | 硅 |