题目内容
11.如图所示是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )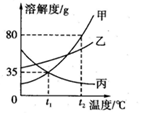
| A. | t2℃时,将50g甲物质加入到50g水中充分搅拌,得到100g甲的饱和溶液 | |
| B. | 将t2℃时甲、乙两种物质的饱和溶液降温到t1℃时,析出晶体的质量:甲>乙 | |
| C. | 将t1℃时三种物质的饱和溶液升温到t2℃时,所得溶液中溶质的质量分数的大小关系是:乙>甲=丙 | |
| D. | 用等质量的甲、乙、丙三种固体配置成t2℃时的饱和溶液,所得溶液质量的大小关系是:丙溶液>乙溶液>甲溶液 |
分析 根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而丙的溶解度随温度的升高而减少;t2℃时,将50g甲物质加入到50g水中充分搅拌,得到饱和溶液的质量=40g+50g=90g,100g甲的饱和溶液是错误的;将t2℃时甲、乙两种物质的饱和溶液降温到t1℃时,析出晶体的质量:甲>乙错误,因为没有指明是等质量的饱和溶液;将t1℃时三种物质的饱和溶液升温到t2℃时,所得溶液中溶质的质量分数的大小关系是:乙>甲>丙,乙>甲=丙是错误的;用等质量的甲、乙、丙三种固体配置成t2℃时的饱和溶液,所得溶液质量的大小关系是:丙溶液>乙溶液>甲溶液正确,因为丙需要的水最多,乙次之,甲最少.
解答 解:A、t2℃时,将50g甲物质加入到50g水中充分搅拌,得到饱和溶液的质量=40g+50g=90g,100g甲的饱和溶液是错误的;故选项错误;
B、将t2℃时甲、乙两种物质的饱和溶液降温到t1℃时,析出晶体的质量:甲>乙错误,因为没有指明是等质量的饱和溶液;故选项错误;
C、将t1℃时三种物质的饱和溶液升温到t2℃时,所得溶液中溶质的质量分数的大小关系是:乙>甲>丙,乙>甲=丙是错误的;故选项错误;
D、用等质量的甲、乙、丙三种固体配置成t2℃时的饱和溶液,所得溶液质量的大小关系是:丙溶液>乙溶液>甲溶液正确,因为丙需要的水最多,乙次之,甲最少;故选项正确;
故选D
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
1.下列推断正确的是( )
| A. | 50mL酒精中加入50mL水,根据溶质守恒可推出酒精溶液的溶质质量分数为50% | |
| B. | 酒精燃烧生成CO2和H2O的分子个数比为2:3,说明酒精分子中C、H原子个数比为1:3 | |
| C. | 少量铁粉放入硝酸银和硝酸铜的混合溶液中,首先析出固体铜 | |
| D. | 铁粉与足量稀盐酸反应,生成三氯化铁和氢气 |
2.维生素B2中含C的质量分数为54.3%,H为5.3%,O为25.5%,N为14.9%.其相对分子质量是376,则维生素B2的化学式为( )
| A. | C16H17O7N4 | B. | C17H22O5N4 | C. | C17H20O6N4 | D. | C18H23O6N3 |
6.相同的元素可以组成不同的物质,如蔗糖(C12H22O11)、酒精(C2H5OH)、醋酸(CH3COOH)、碳酸(H2CO3)四种物质的组成元素相同,下列有关说法不正确的是( )
| A. | 四种物质中,只有碳酸(H2CO3)不属于有机物 | |
| B. | 酒精既是一种溶剂,也是一种重要的燃料 | |
| C. | 蔗糖、醋酸分子中氢、氧原子个数比都为2:1 | |
| D. | 蔗糖由12个碳原子、33个氢原子、11个氧原子构成 |
16.下列实验方案不能达到目的是( )
| A. | 用氢氧化钠溶液吸收二氧化硫 | |
| B. | 用加水的方法区分烧碱和食盐两种固体 | |
| C. | 用点燃的方法区分涤纶和羊毛 | |
| D. | 用点燃的方法除去混在CO2中的CO |
3.下列关于“一定”的说法中,正确的是( )
| A. | 氧化物一定是含氧化合物 | |
| B. | 加入稀盐酸,有无色气体产生的物质中一定含有碳酸盐 | |
| C. | 如果某物质不溶解,就一定不能和其他物质发生复分解反应 | |
| D. | 用燃着的木条伸入某气体中,火焰熄灭,则该气体一定是二氧化碳 |
20.下列实验基本操作正确的是( )
| A. |  稀释浓硫酸 | B. |  蒸发食盐水 | C. |  测定溶液PH值 | D. |  加热试管内液体 |
3.氧化镁在医药、建筑等行业应用广泛,以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶,也不参加反应)为原料制备高纯氧化镁的实验流程如下:

资料:①不同氢氧化物沉淀的pH范围:
②硫在常温下是一种淡黄色固体,硫的熔点约为115.2℃,沸点约为444.7℃;
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2. 试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
800℃
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
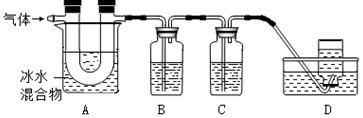
①A中现象是:玻璃管壁出现淡黄色固体;
②B中盛放的溶液可以是a(填字母),实验现象为产生沉淀;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).

资料:①不同氢氧化物沉淀的pH范围:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 8.6 |
| 完全沉淀的pH | 3.2 | 11.1 |
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2. 试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
800℃
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)

①A中现象是:玻璃管壁出现淡黄色固体;
②B中盛放的溶液可以是a(填字母),实验现象为产生沉淀;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).
