题目内容
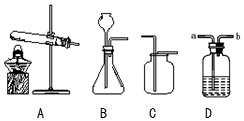
13.如图1是实验室常用的一些仪器,请按要求作答:
(1)写出仪器B、D的名称:B试管,D烧杯.
(2)写出实验室用高锰酸钾制取氧气的方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)实验室制取CO2的药品是大理石(写名称)和稀盐酸(写名称),装配一个使反应随时发生和停止的装置来制取CO2,应选图1仪器中的CDEIJKL(填序号).
(4)设计一套取少量蒸馏水的简易装置,需选择图1中的仪器AFH和BCDHK(填序号).
(5)已知乙炔(C2H2)气体可用水和CaC2反应制取.请你完成制取乙炔的化学反应方程式:CaC2+2H2O═Ca(OH)2+C2H2↑.乙炔气中常含酸性杂质气体CO2和H2S,请在图2方框中补画出除杂装置(导气管用直线表示),并标注必要的试剂.
分析 (1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气进行分析;
(3)根据实验室制取二氧化碳的反应物是大理石和稀盐酸,该反应的反应物是固体和液体,反应条件是常温,反应随时发生和停止,二氧化碳的密度比空气大,溶于水进行分析;
(4)根据蒸馏装置所需要的仪器来选择,需要加热、加热水的仪器等进行分析;
(5)根据碳化钙和水反应生成氢氧化钙和乙炔,洗气应该是长进短出,常用碱性溶液吸收酸性气体进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,B是试管,D是烧杯;
(2)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)实验室制取二氧化碳的反应物是大理石和稀盐酸,该反应的反应物是固体和液体,反应条件是常温,反应随时发生和停止,二氧化碳的密度比空气大,溶于水,所以应选图1仪器中的CDEIJKL;
(4)蒸馏装置所需要的仪器来选择,需要加热、加热水的仪器等,所以需选择图1中的仪器AFH和BCDHK;
(5)碳化钙和水反应生成氢氧化钙和乙炔,化学方程式为:CaC2+2H2O═Ca(OH)2+C2H2↑,洗气应该是长进短出,常用碱性溶液吸收酸性气体,所以装置图为:
.
故答案为:(1)试管,烧杯;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)大理石,稀盐酸,CDEIJKL;
(4)AFH;
(5)2H2O,Ca(OH)2,
.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

 阅读快车系列答案
阅读快车系列答案| 物质 | 杂质 | 除杂试剂 | 提纯方法 | |
| A | H2O | NaOH | 活性炭 | 吸附、过滤 |
| B | Na2SO4 | Na2CO3 | 盐酸 | 加入盐酸至不再产生气泡 |
| C | KCl | MnO2 | H2O | 溶解、过滤、蒸发 |
| D | CO2 | CO | O2 | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 气体受热膨胀--气体分子间的间隔变大 | |
| B. | 两块平整的玻璃不能压成一块玻璃--分子间的斥力大于引力 | |
| C. | 走过花园,闻到花香--分子在不停地做热运动 | |
| D. | 氢气和氧气反应生成水--分子分成原子,原子重新组合成分子 |
| A. | Mg+O2═MgO2 | B. | C+O2═CO2 | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2↑ | D. | 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 |
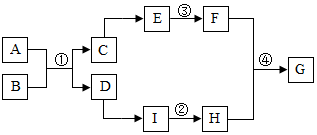 A~I都是初中化学中常见的物质,已知,A是一种无色无味的气体,C是应用最广泛的金属,I是建筑材料的主要成分,F是实验室常用的溶剂,它们的转化关系如图所示,其它有关物质未列出.下列说法错误的是( )
A~I都是初中化学中常见的物质,已知,A是一种无色无味的气体,C是应用最广泛的金属,I是建筑材料的主要成分,F是实验室常用的溶剂,它们的转化关系如图所示,其它有关物质未列出.下列说法错误的是( )| A. | 向物质G的水溶液中滴入无色酚酞试液,溶液变红色 | |
| B. | ②和③的化学反应类型相同 | |
| C. | 反应②是吸热反应,反应④是放热反应 | |
| D. | 物质A和物质E都具有可燃性 |


 根据如图所示装置回答问题.
根据如图所示装置回答问题.