题目内容
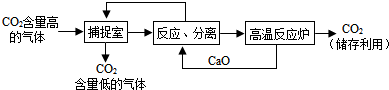
11.钢铁工业是一个国家的支柱产业之一.如图1是工业炼铁的基本生产流程示意图.请回答下列问题:
(1)写出图1中设备A 的名称:高炉.
(2)同学采集了一些生铁样品(含杂质,
杂质不溶于水,不与稀硫酸反应)采用如图2所示装置进行分析.分别称得锥形瓶与棉花的质量为44.1g,生铁样品的质量为9.0g.在锥形瓶中加入足量稀硫酸后,立即开始记录电子天平的示数,记录数据如图3请认真分析数据,回答下列问题:
(1)小军数据处理的图象中正确的是B.

(2)计算样品中铁的质量分数(请写明过程).
(3)计算反应后所得溶液中硫酸亚铁的质量分数(请写明过程).
分析 (1)工业炼铁又称为高炉炼铁,因为工业炼铁使用的设备为高炉;
(2)根据反应记录数据,完全反应放出氢气质量=159.0g-158.7g=0.3g,加入稀硫酸的质量=159.0g-44.1g-9.0g=105.9g;结合反应的化学方程式,由生成氢气的质量计算生铁中铁的质量、反应生成硫酸亚铁的质量等,完成分析和计算
解答 解:(1)工业炼铁所使用的设备为高炉,炼铁过程是在高炉内完成的;
故答案为:高炉;
(2)①由于生铁样品中的杂质不溶于水且不与酸发生反应,因此反应停止后样品的质量不为0;所以图A所示的分析错误;
随着生铁不断与稀硫酸反应,放出氢气质量逐渐增大,至完全反应,放出氢气的质量=159.0g-158.7g=0.3g;所以图B的分析正确;
加入稀硫酸的质量=159.0g-44.1g-9.0g=105.9g,反应使溶液的质量逐渐增大,直到反应停止溶液质量不再改变;所以图C的分析错误;
故答案为:B;
②③设反应的铁的质量为x,生成的硫酸亚铁的质量为y
Fe+H2SO4═FeSO4+H2↑
56 152 2
x y 0.3g
$\frac{56}{x}$=$\frac{2}{0.3g}$
解得 x=8.4g
$\frac{152}{y}$=$\frac{2}{0.3g}$
解得 y=22.8g
铁的质量分数=$\frac{8.4g}{9g}$×100%=93.3%
硫酸亚铁的溶质质量分数=$\frac{22.8g}{159.0-9.0-44.1g+8.4g-0.3g}$×100%=20%
答:样品中铁的质量分数为93.3%,硫酸亚铁的溶质质量分数为20%.
点评 根据质量守恒定律,反应后所得溶液的质量=所加稀盐酸的质量+参加反应铁的质量-放出氢气的质量

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案| A. | 熟石灰可用来改良酸性土壤,因为熟石灰呈碱性 | |
| B. | 洗涤剂常用来洗涤油污,因为洗涤剂能把油污溶解 | |
| C. | “银粉漆”(铝粉)可涂在铁栏杆上防锈,因为铝的化学性质稳定 | |
| D. | 一氧化碳用于冶炼金属,因为一氧化碳具有可燃性 |
 食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末.
食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末.【提出问题】该脱氧剂中的黑色是什么?
【提出猜想】黑色粉末可能含炭粉、铁粉、氧化铜中的一种或几种.
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取脱氧剂黑色粉末加入足量稀硫酸 | 粉末几乎全部溶解,只有少量黑色粉末未溶解,有气泡产生,溶液为浅绿色色 |
| ② | 实验①的残渣灼烧,将内壁有 澄清石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 |
【拓展延伸】小明认为铁生锈时会消耗氧气,因此可用此脱氧剂(实验室可滴几滴水)测定空气中氧气的含量,装置如图所示.集气瓶的实际容积是150mL,量筒内盛100mL的水.当量筒 内水面不再变化,且温度回复至室温时,读出水面在73mL刻度处.由上述实验数据可以算出,空气中氧气的体积分数是18%.本实验的测量结果与理论值不一致,原因可能是脱氧剂不足等.
| A. | 红磷在空气中燃烧产生大量的白雾 | B. | 铁丝在空气中剧烈燃烧,火星四射 | ||
| C. | 氢气在氧气中燃烧发出蓝紫色火焰 | D. | 镁条在空气中燃烧发出耀眼的白光 |
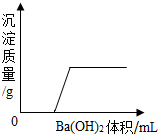 某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )
某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )| A. | HCl和MgCl2一定存在 | |
| B. | NaOH、H2SO4和MgCl2一定不存在 | |
| C. | HCl和H2SO4一定存在 | |
| D. | HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在 |