题目内容
20.自然界中有几千万种含碳物质,并在不断地循环转化,生命活动更离不开碳循环.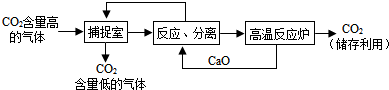
(1)自然界中无机碳(非有机物中的碳)转化为有机碳(有机物中的碳)的主要途径是:光合作用.
(2)“碳捕捉技术”是一种人为干预碳循环的方法:它将工业生产中产生的二氧化碳分离出来并加以利用.某科研小组的同学设计用氢氧化钠溶液来“捕捉”二氧化碳,其基本过程如图(部分条件及物质未标出):
①“捕捉室”中发生反应的化学方程式为2NaOH+CO2=H2O+Na2CO3.
②在整个“捕捉”过程中,可以循环利用的物质是NaOH或CaO.
分析 (1)根据自然界中消耗二氧化碳的主要途径是光合作用解答;
(2)根据题干提供的信息进行分析,捕捉室中含有氢氧化钠溶液,氢氧化钠能与二氧化碳反应生成碳酸钠和水;氧化钙能与水反应生成氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,碳酸钙可以高温分解生成氧化钙和二氧化碳,据此解答.
解答 解:
(1)自然界中消耗二氧化碳的主要途径是光合作用;
(2)
①捕捉室中含有氢氧化钠溶液,氢氧化钠能与二氧化碳反应生成碳酸钠和水,故填:2NaOH+CO2=Na2CO3+H2O;
②在循环的过程中,氧化钙和氢氧化钠都可以循环利用,故填:氧化钙、氢氧化钠;
答案:
(1)光合作用;
(2)①2NaOH+CO2=H2O+Na2CO3; ②NaOH或CaO.
点评 本题考查了减少二氧化碳排放的方法,完成此题,可以依据已有的物质的性质进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列各种说法中,满足质量守恒定律的是( )
| A. | 硫酸铜溶液与氢氧化钠溶液反应前后溶液的总质量不变 | |
| B. | 氢氧化钠溶液与稀盐酸反应前后溶液中的溶质总质量减少了 | |
| C. | 一氧化碳还原氧化铜的反应前后固体总质量不变 | |
| D. | 硫酸与碳酸钠溶液反应前后溶液中的溶剂总质量不变 |
5.为了探究溶质在水中溶解速率的影响因素,某学习小组设计了如下实验:下列说法中正确的是( )


| A. | 对比实验①和②,可探究水的温度对溶质在水中溶解速率的影响 | |
| B. | 对比实验②和③,可探究水的温度对溶质在水中溶解速率的影响 | |
| C. | 对比实验②和③,可探究固体溶质的颗粒大小对溶质在水中溶解速率的影响 | |
| D. | 对比实验①和③,可探究固体溶质的颗粒大小对溶质在水中溶解速率的影响 |
9.小科完成“氢气还原氧化铜”的实验后,没等装置冷却就停止通入氢气,导致部分已生成的铜再次被氧化为了探究产生的氧化铜的含量,他取试管内的混合物10g,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于如表:
试回答下列问题:
(1)上述表格中的m的值为3,10g样品中CuO的质量为7g;
(2)求所加稀硫酸的溶质质量分数;
(3)表格中所得溶液的硫酸铜质量分数P1、P2、P3、P4的大小关系为P1=P2=P3>P4.
| 试验次数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 充分反应后剩余固体的质量/g | 8 | 6 | 4 | 3 | m |
| 所得溶液的硫酸铜质量分数/% | P1 | P2 | P3 | P4 | P5 |
(1)上述表格中的m的值为3,10g样品中CuO的质量为7g;
(2)求所加稀硫酸的溶质质量分数;
(3)表格中所得溶液的硫酸铜质量分数P1、P2、P3、P4的大小关系为P1=P2=P3>P4.
10.下列相关事实用微观粒子的知识解释正确的是( )
| 选项 | 事实 | 解释 |
| A | 酒精温度计受热液柱上升 | 原子间间隔受热变大 |
| B | 碳酸钠溶液显碱性,稀硫酸显酸性 | 不同种物质的分子化学性质不同 |
| C | 氨水和氢氧化钠溶液都能使酚酞溶液变红 | 溶液中都含有相同的阴离子 |
| D | 金刚石和石墨的性质差异较大 | 碳原子的结构不同 |
| A. | A | B. | B | C. | C | D. | D |


 如图所示,瓶中X为固体,当把滴管内的液体Y滴入瓶中,导管口没有气泡产生的是( )
如图所示,瓶中X为固体,当把滴管内的液体Y滴入瓶中,导管口没有气泡产生的是( )