题目内容
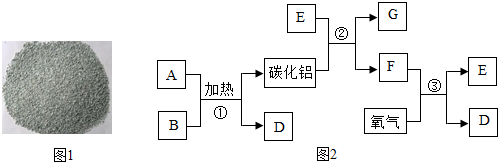
11. 甲、乙、丙、X是初中化学常见的物质,且甲、乙、丙3种物质属于单质、氧化物、酸、碱、盐中的不同类别.X与甲、乙、丙的关系如图所示(图中“-----”表示两端的物质能发生反应).
甲、乙、丙、X是初中化学常见的物质,且甲、乙、丙3种物质属于单质、氧化物、酸、碱、盐中的不同类别.X与甲、乙、丙的关系如图所示(图中“-----”表示两端的物质能发生反应).(1)若将X放入丙溶液中,观察到X表面变红,溶液由蓝色变为浅绿色.则X为铁;将X放入乙溶液中,观察到的现象是固体减少,有气泡产生,溶液变为浅绿色;写出X与甲反应的化学方程式3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
(2)若乙与丙不含相同元素,且乙与丙反应可以生成甲,甲可用于灭火.向X与乙、X与丙反应后的溶液中滴加酚酞溶液,溶液分别变为无色和红色.则X与甲反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;X与乙反应后溶液中溶质的组成可能为CaCl2、HCl;CaCl2.(只写一种)
分析 (1)金属具有的化学性质有:与盐溶液的反应、与氧气的反应、与酸的反应;根据将X放入丙溶液中,观察到X表面变红,溶液由蓝色变为浅绿色,说明是铁和铜的盐溶液发生置换反应产生了铜和亚铁的盐溶液;将X放入乙溶液中,说明是铁和酸的反应;X与甲反应,则是铁与氧气的反应;
(2)根据甲可用于灭火,因此是二氧化碳,则乙与丙就是酸和碳酸盐;向X与丙反应后的溶液中滴加酚酞溶液,溶液变为红色,说明有碱的产生,则丙是碳酸盐,如常见的碳酸钠;向X与乙反应后的溶液中滴加酚酞溶液,溶液变为无色,说明溶液可能显酸性也可能是中性,则乙是酸,X是碱,发生酸碱中和,可能是完全反应,也可能是酸过量,根据推断完成相关的问题.
解答 解:(1)将X放入丙溶液中,观察到X表面变红,溶液由蓝色变为浅绿色,铁和铜的盐溶液发生置换反应产生了铜和亚铁的盐溶液,所以X是铁;将X放入乙溶液中,说明是铁和酸的反应,会产生氢气和亚铁的盐溶液,故看到的现象为:固体减少,有气泡产生,溶液变为浅绿色;X与甲反应,则是铁与氧气的反应产生四氧化三铁,故反应的方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;故答案为:铁;固体减少,有气泡产生,溶液变为浅绿色;3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
(2)甲可用于灭火,因此是二氧化碳,则乙与丙就是酸和碳酸盐;向X与丙反应后的溶液中滴加酚酞溶液,溶液变为红色,说明有碱的产生,则丙是碳酸盐,如常见的碳酸钠;向X与乙反应后的溶液中滴加酚酞溶液,溶液变为无色,说明溶液可能显酸性也可能是中性,则乙是酸,如常见的盐酸,X是碱,发生酸碱中和,可能是完全反应,也可能是酸过量;X是氢氧化钙,因为既能够和二氧化碳反应又能够和酸、碳酸盐反应;故甲的化式为:CO2;X与甲反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;X与乙反应后溶液中溶质的组成可能为:CaCl2、HCl;CaCl2.
故答案为:
(1)铁; 固体减少,有气泡产生,溶液变为浅绿色; 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
(2)Ca(OH)2+CO2=CaCO3↓+H2O; CaCl2、HCl;CaCl2.
点评 此题为物质推断题,在解此类题时,先将题中有特征的物质推出,然后再根据推出的物质和题中的其他反应推出剩余的物质,最后再进行验证即可.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【查阅资料】电石的主要成分是碳化钙(CaC2),可以与水反应生成一种可燃性气体及白色固体.常见的可燃性气体中,乙炔(C2H2)燃烧时伴有大量黑烟.
【猜想与假设】电石与水反应生成的可燃性气体是:氧气、氢气或乙炔(C2H2);电石与水反应生成的白色固体是:氧化钙、氢氧化钙或碳酸钙.大家做出以上推断的理由是质量守恒定律反应前后元素的种类不变
大家讨论后一致认为该气体不可能是氧气,原因是氧气不能燃烧,白色固体不可能是氧化钙,原因是(用化学方程式表示)CaO+H2O=Ca(OH)2.
【实验探究】
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取适量电石加水反应,收集生成的气体,验纯后点燃. | 气体燃烧,产生黄色火焰并伴有浓烈黑烟. | 电石与水反应产生的气体是乙炔(C2H2) |
| (2)取适量反应后生成的固体于试管中,滴加过量稀盐酸. | 固体溶解,不产生气泡. | 电石与水反应产生的固体不是碳酸钙 |
| (3)取适量反应后生成的固体于试管中加水,向上层清液中滴加2~3滴无色酚酞. | 溶液变红 | 电石与水反应产生的固体是氢氧化钙 |
| 化学符号 | (1)2N2 | 3H | (3)NO3- | 氧化铜中铜元素化合价 |
| 符号的意义 | 2个氮分子 | (2)3个氢原子 | 硝酸根离子 | (4)$\stackrel{+2}{Cu}$O |
静置,取上层清液,加入锌粉,充分反应后过滤,得到滤液甲和滤渣乙.请完成以下探究(不考虑杂质干扰).
【提出问题】滤渣乙是什么?
【做出猜想】小明认为滤渣乙是银,小东认为滤渣乙是银和铜,小华认为滤渣乙是银、铜和铝,你认为滤渣乙还可能是银、铜和锌.
【交流讨论】大家经过讨论后,认为小华的猜想错误,理由是锌不和硝酸铝溶液反应.
【实验探究】设计实验探究滤渣乙的成分,请填写下列空白:
| 实验步骤 | 现象 | 结论 |
| 实验1:取滤渣乙加入盐酸 | 无气体产生 | 滤渣乙可能是银或铜和银 |
| 实验2:取滤液甲加入氢氧化钠 | 无蓝色沉淀 | 滤渣乙一定是铜和银 |
【反思交流】通过交流,大家认为在滤液甲中加入稀盐酸,当观察到无变化,也能得出实验1的结论.
写出此反应涉及的化学方程式HCl+AgNO3=HNO3+AgCl↓.