题目内容
1.如图是实验室制取气体常用的两套装置.
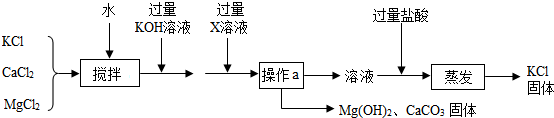
(1)选择装置A制取二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,采用向上排空气法收集二氧化碳的原因是二氧化碳的密度大于空气的密度,验满二氧化碳的方法是用燃着木条放到集气瓶口,如果木条熄灭,则证明二氧化碳收集满.
(2)选择装置B用高锰酸钾制取氧气,反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,收集氧气的方法是排水法;若实验结束后发现试管破裂,可能的原因之一是实验完毕后先熄灭酒精灯后撤导气管.
分析 (1)根据实验室用稀盐酸和碳酸钙反应制取二氧化碳以及二氧化碳的性质进行解答;
(2)根据高锰酸钾加热生成锰酸钾、二氧化锰和氧气以及氧气的性质和注意事项进行解答.
解答 解:(1)实验室用稀盐酸和碳酸钙反应制取二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;采用向上排空气法收集二氧化碳的原因是:二氧化碳的密度大于空气的密度;验满二氧化碳的方法是:用燃着木条放到集气瓶口,如果木条熄灭,则证明二氧化碳收集满;
(2)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;氧气不易溶于水,所以收集氧气的方法是排水法;若实验结束后发现试管破裂,可能的原因之一是:实验完毕后先熄灭酒精灯后撤导气管.
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳的密度大于空气的密度;用燃着木条放到集气瓶口,如果木条熄灭,则证明二氧化碳收集满;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;排水法;实验完毕后先熄灭酒精灯后撤导气管.
点评 本考点主要考查气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写,综合性比较强.

练习册系列答案
相关题目
11.在一次化学实验操作考核中,某班同学有如下几种操作和应急措施,其中不正确的是( )
| A. |  酒精灯失火 | B. |  配制溶液 | ||
| C. |  闻气味 | D. |  分离溶液中的KNO3晶体 |
9.我国民间有端午节挂艾草的习俗.艾草含有丰富的黄酮素(化学式为:C15H30O2),它有很高的药用价值.请你计算:
(1)黄酮素的相对分子质量为242.
(2)黄酮素中碳元素与氧元素的质量比为45:8.
(1)黄酮素的相对分子质量为242.
(2)黄酮素中碳元素与氧元素的质量比为45:8.
16.下列有关化学反应类型的判断错误的是( )
| A. | SO3+H2O=H2SO4化合反应 | |
| B. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑分解反应 | |
| C. | 2Al+WO3$\frac{\underline{\;高温\;}}{\;}$Al2O3+W置换反应 | |
| D. | 2NaOH+CO2=Na2CO3+H2O复分解反应 |
6.下列说法中不正确的是( )
| A. | CO和CO2分子构成不同,所以化学性质不同 | |
| B. | 原子不显电性,是因为原子中不存在带电的粒子 | |
| C. | 不同元素最本质的区别是原子核内质子数不同 | |
| D. | 原子得到或失去电子就变成离子 |
13.漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,既可用作漂白剂,又可用作消毒剂.漂白粉中有效成分是[Ca(ClO)2],漂白的原理是Ca(ClO)2在空气中发生反应:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色.
(1)漂白粉是一种混合物(填“纯净物”或“混合物”).
(2)HClO在常温下分解,反应方程式为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH减小 (填“增大”或“减小”或“不变”).
(3)在漂白粉中滴加盐酸,能加快漂白的速率.写出漂白粉中加入盐酸反应的化学方程式Ca(ClO)2+2HCl=CaCl2+2HClO.
(4)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列实验探究.
【提出问题】长时间放置的漂白粉是否变质?
【猜想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3.
【实验探究】限选试剂及仪器:盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
(1)漂白粉是一种混合物(填“纯净物”或“混合物”).
(2)HClO在常温下分解,反应方程式为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH减小 (填“增大”或“减小”或“不变”).
(3)在漂白粉中滴加盐酸,能加快漂白的速率.写出漂白粉中加入盐酸反应的化学方程式Ca(ClO)2+2HCl=CaCl2+2HClO.
(4)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列实验探究.
【提出问题】长时间放置的漂白粉是否变质?
【猜想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3.
【实验探究】限选试剂及仪器:盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量盐酸,塞上带导管的单孔塞, 把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色. |
2.对物质进行分类研究,是学习化学的重要方法.下列物质的分类正确的是( )
| A. | 单质:金刚石、水银、钢 | B. | 碱:烧碱、纯碱、熟石灰 | ||
| C. | 氧化物:水、干冰、过氧化钠 | D. | 酸:硫酸、硝酸、碳酸钙 |