题目内容
1.下列实验现象描述正确的是( )| A. | 铜片放入硝酸银溶液中:紫红色固体表面有银白色固体析出,溶液由无色逐渐变为蓝色 | |
| B. | 打开浓盐酸试剂瓶,在瓶口有白烟产生 | |
| C. | 铁丝在空气中加热:银白色固体剧烈燃烧,火星四射,放出大量的热,生成黑色固体 | |
| D. | 铜片放入稀盐酸中:紫红色固体表面产生气泡,固体减少,溶液由无色逐渐变为蓝色,放热 |
分析 A、根据铜和硝酸银反应生成硫酸铜和银,溶液由无色变成蓝色进行分析;
B、根据浓盐酸易挥发,在空气中容易形成白雾,进行分析;
C、根据铁丝在氧气中燃烧的现象进行分析判断;
D、根据金属活动性顺序解答进行分析判断.
解答 解:A、铜和硝酸银反应生成硫酸铜和银,紫红色固体表面有银白色固体产生,溶液由无色变成蓝色,故A说法正确;
B、打开浓盐酸试剂瓶的瓶塞,瓶口上方出现大量白雾,而非有白烟产生,故B说法错误;
C、铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,而不是在空气中,故C说法错误;
D、在金属活动性顺序中,铜位于氢的后面,与酸不反应,故D说法错误.
故选:A.
点评 本题难度不大,掌握常见金属的活动性即可正确解答;在描述物质燃烧的现象时,需要注意光和火焰、烟和雾的区别,实验现象必须是感官能够感受到的.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 要使氯酸钾受热分解,必须加入二氧化锰,否则反应不能发生 | |
| B. | 使用二氧化锰,可使氯酸钾分解产生更多的氧气 | |
| C. | 使用二氧化锰,可以使氯酸钾在较低温度下分解 | |
| D. | 在工业上,主要用分离液态空气的方法制取氧气,这个过程属于分解反应 |
12.判断硫在氧气里燃烧是化学变化的主要依据是( )
| A. | 放出大量的热 | B. | 生成有刺激性气味的二氧化硫气体 | ||
| C. | 物质的颜色发生变化 | D. | 固体变成液体最后变成气体 |
9.从化学的角度分析,下列做法不合理的是( )
| A. | 氮气的化学性质不活泼,用于食品防腐 | |
| B. | 生活中通过煮沸可以降低水的硬度 | |
| C. | 城市道路使用的太阳能景观灯,节能又环保 | |
| D. | 采用燃烧氢气的方式生产水,补充城市饮用水资源的不足 |
16.下列有关实验室制取氧气的说法中,不正确的是( )
| A. | 排空气法收集氧气,带火星的木条放在集气瓶瓶口来验满 | |
| B. | 加热氯酸钾时如果不加入二氧化锰也可获得氧气 | |
| C. | 过氧化氢分解能得到氧气是因为过氧化氢中含有氧气 | |
| D. | 氯酸钾加热制取氧气,用少量高锰酸钾来代替二氧化锰也可获得大量氧气 |
6.下列有关资源或能源的叙述不正确的是( )
| A. | 地壳中含量最高的金属元素是铝,年产量最高的金属是铁 | |
| B. | 海洋中有80多种元素,是巨大的资源宝库,其中含量最多的元素是氢 | |
| C. | 回收废旧电池能节约金属资源,减少环境污染 | |
| D. | 我国是世界上已知矿物种类比较齐全的少数国家之一,钨、钛等储量居世界前列 |
10.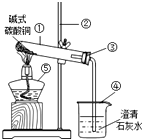 某化学兴趣小组为了探究氧化铜能否代替二氧化锰作为双氧水的催化剂,进行以下探究:
某化学兴趣小组为了探究氧化铜能否代替二氧化锰作为双氧水的催化剂,进行以下探究:
实验准备:氧化铜可以利用加热碱式碳酸铜来制取
(1)试管中碱式碳酸铜加热前后的颜色变化由绿色变为黑色;
(2)烧杯中反应的文字表达式为二氧化碳+氢氧化钙→碳酸钙+水.
【实验一】
【实验二】
实验目的:探究氧化铜在反应前后质量是否改变
实验步骤:在实验后,该同学将反应剩余物过滤、洗涤、干燥、称量.得到黑色固体0.1g
实验结论:氧化铜的质量在化学反应前后不变.
【实验三】
实验目的:探究氧化铜在化学反应前后化学性质是否改变
实验步骤:待步骤②试管中不再产生气泡后,继续向试管内加入2mL5%的过氧化氢溶液,伸入带火星的小木条,看到小木条复燃,说明氧化铜还能继续加快双氧水分解.
实验结论:氧化铜在反应前后化学性质不变.
 某化学兴趣小组为了探究氧化铜能否代替二氧化锰作为双氧水的催化剂,进行以下探究:
某化学兴趣小组为了探究氧化铜能否代替二氧化锰作为双氧水的催化剂,进行以下探究:实验准备:氧化铜可以利用加热碱式碳酸铜来制取
(1)试管中碱式碳酸铜加热前后的颜色变化由绿色变为黑色;
(2)烧杯中反应的文字表达式为二氧化碳+氢氧化钙→碳酸钙+水.
【实验一】
| 实验步骤 | 实验现象 | 实验结论 |
| ①在试管中加入2ml5%的过氧化氢溶液,将带火星的小木条伸入试管中 | 木条不复燃 | 在常温下,双氧水分解速率很慢 |
| ②在试管中加入2ml5%的过氧化氢溶液,加入0.1g的氧化铜,将带火星的小木条伸入试管 | 木条复燃 | 氧化铜可以加快双氧水的分解速率 |
实验目的:探究氧化铜在反应前后质量是否改变
实验步骤:在实验后,该同学将反应剩余物过滤、洗涤、干燥、称量.得到黑色固体0.1g
实验结论:氧化铜的质量在化学反应前后不变.
【实验三】
实验目的:探究氧化铜在化学反应前后化学性质是否改变
实验步骤:待步骤②试管中不再产生气泡后,继续向试管内加入2mL5%的过氧化氢溶液,伸入带火星的小木条,看到小木条复燃,说明氧化铜还能继续加快双氧水分解.
实验结论:氧化铜在反应前后化学性质不变.
11.下列物质按混合物 纯净物 单质 氧化物顺序排列的是( )
| A. | 空气 冰水 金刚石 氯酸钾 | |
| B. | 洁净的空气 氯化钠 液氧 蒸馏水 | |
| C. | 稀有气体 海水 铁 氧化铝 | |
| D. | 澄清石灰水 水银 氦气 二氧化碳 |