题目内容
2.如表关于物质保存方法的原因,不正确的是( )| 选项 | 保存方法 | 原 因 |
| A | 浓硫酸应密封保存 | 浓硫酸在空气中易吸水 |
| B | 氢氧化钠应密封保存 | 氢氧化钠易与空气中的氧气反应 |
| C | 浓盐酸应密封保存 | 浓盐酸易挥发 |
| D | 白磷应保存在冷水中 | 水中无充足氧气且白磷着火点低 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、依据浓硫酸的吸水性分析解答;
B、依据氢氧化钠能潮解并与二氧化碳反应分析即可;
C、依据浓盐酸的挥发性分析;
D、根据白磷的性质方法;
解答 解:A、浓硫酸具有吸水性不具挥发性,放置在空气中会因吸水而浓度降低,故需密封保存,故正确;
B、氢氧化钠在空气中易潮解并能与二氧化碳反应生成碳酸钠和水,所以必须密封保存,故不正确;
C、浓盐酸有挥发性,所以为防止氯化氢的挥发必须密封保存,故正确;
D、白磷的着火点低,应保存在冷水中,故正确;
故选:B.
点评 掌握相应物质的性质,根据性质分析选择保存方法的原因解答本题的关键.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
10.在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体.某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用.
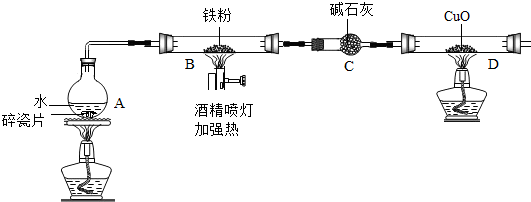
(1)【推断】观察到D中黑色固体变红,则B中生成的气体是氢气.
(2)探究B装置中剩余固体成分是什么?
【查阅资料】
1.碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
2.铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引.
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe3O4
猜想二:剩余固体是Fe与Fe3O4
【实验探究】
【实验结论】铁与水蒸气反应的化学方程式为3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
(3)【成分再利用】若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为0.03a≤x<0.43a.

(1)【推断】观察到D中黑色固体变红,则B中生成的气体是氢气.
(2)探究B装置中剩余固体成分是什么?
【查阅资料】
1.碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
2.铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引.
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe3O4
猜想二:剩余固体是Fe与Fe3O4
【实验探究】
| 实验操作 | 实验现象及结论 |
(3)【成分再利用】若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为0.03a≤x<0.43a.
14.甲图是一氧化碳还原氧化铁的装置,乙图是炼铁高炉示意图.下列叙述中正确的是( )


| A. | 乙图炼铁中原料焦炭的作用是只提供热量 | |
| B. | 炼铁的主要原理是:3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| C. | 甲图中实验开始时应先点燃加热氧化铁的酒精喷灯,再点燃酒精灯 | |
| D. | 两图中得到的铁是完全相同的 |
12.下列关于水的说法正确的是( )
| A. | 保护水资源,禁止使用化肥、农药 | |
| B. | 用活性炭净水,发生的是化学变化 | |
| C. | 生产、生活用水不经处理直接排放 | |
| D. | 保持水化学性质的最小微粒是水分子 |



 水是重要资源.
水是重要资源.