题目内容
2.在实验室中可选择如图装置制取气体.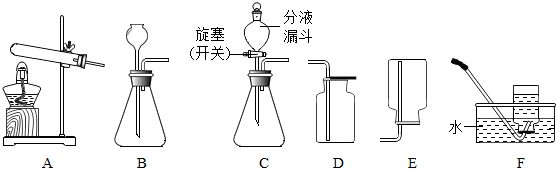
(1)若选择A、F组合一套装置制取了某气体,请写出有关反应的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(2)写出制取H2的化学方程式为Zn+H2SO4=ZnSO4+H2↑;其发生装置可选择B或C,与B相比较,C的主要优点是什么?
(3)若用石灰石和稀盐酸反应来制取二氧化碳,应选择以上哪些装置;并写出对应的化学方程式.
分析 制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集;实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.
解答 解:(1)如果用氯酸钾制氧气就需要加热,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集;与B相比较,C的主要优点是:可以控制反应的速度;故答案为:Zn+H2SO4=ZnSO4+H2↑;可以控制反应的速度;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;故答案为:BD或CD;CaCO3+2HCl=CaCl2+H2O+CO2↑;
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和装置的优点等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

| A. | 金刚石用于裁玻璃--金刚石很硬 | |
| B. | 石墨用于制铅笔芯--石墨很软 | |
| C. | 干冰用于人工降雨--干冰易升华同时吸收大量的热 | |
| D. | 一氧化碳用于冶金工业--一氧化碳能够燃烧 |
(1)自然界中二氧化碳消耗主要有以下两个过程:①绿色植物在光照、叶绿素条件下进行光合作用吸收二氧化碳和水生成葡萄糖(C6H12O6)和氧气.②自然界中的水体吸收二氧化碳生成碳酸.从物质转化的角度看,上述两个反应的反应物相同,而产物却完全不同,其原因是反应条件不同.
光合作用的化学方程式是 6CO2+6H2O$\frac{\underline{\;叶绿素\;}}{光照}$C6H12O6+6O2 .
(2)二氧化碳可被压缩成液态,封存在地质结构中.从微观角度解释二氧化碳能够压缩成液态的原因是二氧化碳分子之间有间隔.如果 CO2被封存在含氢氧化钙的地下水层中,则可转化为不溶于水的固体物质,该反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O.
(3)科学家利用太阳能可将二氧化碳和水转化为“合成气”(H2和 CO 混合气体).用“合成气”为原料生产甲醇(CH4O)时,按照“绿色化学”原则,应调节“合成气”中 H2 和 CO 的分子个数比为 2:1.(4)利用表中装置可分别进行如下两个实验.已知:白磷的着火点为40℃.
| 实验装置 | 实验1 | 实验2 |
 | I.将盛有足量锌粒的燃烧匙伸入瓶中,塞紧瓶塞 II.打开 K,从长颈漏斗向瓶内加入稀硫酸,至浸没锌粒 III.当瓶中产生大量气泡时,关闭K | I.将盛有白磷的燃烧匙伸入瓶内,塞紧瓶塞 II.打开 K,从长颈漏斗向瓶内加入约80℃的热水,至浸没白磷 III.从 a 口向瓶中鼓入空气,使瓶中液面低于燃烧匙底部,关闭K |
②实验Ⅰ中,瓶内发生反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑;步骤Ⅲ中,关闭K后的现象是瓶内液面逐步缓缓下降,长颈漏斗中的液面上升,反应会因为瓶中液面过低而停止.
③实验2中,所看到实验现象是有气泡产生仅对比步骤Ⅱ和Ⅲ可知,欲探究的燃烧条件是燃烧需要氧气.
| 物质 | A | B | C | 新物质D |
| 反应前物质质量/g | 30 | 30 | 30 | 0 |
| 反应后物质质量/g | 待测 | 33 | 0 | 22 |
| A. | C物质有可能是单质 | |
| B. | 变化后待测物A的质量为35g | |
| C. | 该变化的基本反应类型是分解反应 | |
| D. | C物质中所含有的元素种类是A、B、D三种物质中所有元素种类之和 |
| A. | Na2CO3溶液 | B. | 稀盐酸 | C. | 石蕊溶液 | D. | 酚酞溶液 |
| A. | 用闻气味的方法区别氧气和二氧化碳 | |
| B. | 用肥皂水鉴别硬水和软水 | |
| C. | 用稀硫酸区分黄铜(Cu、Zn)和黄金 | |
| D. | 用石灰水鉴别氢气和二氧化碳 |
 根据如图实验(图A),回答以下问题.
根据如图实验(图A),回答以下问题.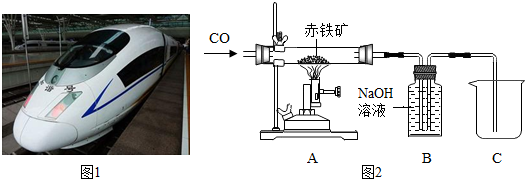
 如图是某反应的微观示意图,下列说法正确的是C
如图是某反应的微观示意图,下列说法正确的是C 和
和  的质量比为17:24.
的质量比为17:24.