题目内容
【题目】硬水不仅对人体健康有害,而且会给生活带来很多麻烦。硬水受热后会产生水垢,水垢的主要成分是碳酸钙和氢氧化镁。实验室用水垢制取纯净氯化钙固体的流程如下(假设水垢中的其他成分不参与反应),请回答下列问题:

(1)生活中常用___________________区别硬水和软水。
(2)步骤②中生成沉淀的化学反应方程式是______________________。
(3)步骤④中加入过量稀盐酸的目的是______________________。
(4)步骤⑤是利用______________________的方法得到氯化钙固体。该操作中玻璃棒的作用是__________。
【答案】肥皂水 ![]() 将滤液中的氢氧化钙完全转化为氯化钙 蒸发结晶 搅拌,防止因局部温度过高,造成液体飞溅
将滤液中的氢氧化钙完全转化为氯化钙 蒸发结晶 搅拌,防止因局部温度过高,造成液体飞溅
【解析】
(1)生活中常用肥皂水来区分硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多,故填:肥皂水;
(2)水垢的主要成分是碳酸钙和氢氧化镁,加入过量稀盐酸,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,氢氧化镁和稀盐酸反应生成氯化镁和水,由于该实验是制取纯净氯化钙固体,故应将氯化镁除去,可加入氢氧化钙,氢氧化钙与氯化镁反应生成氢氧化镁和氯化钙,该反应的化学方程式为:![]() ;
;
(3)由于步骤②中加入了过量的氢氧化钙,故步骤④中加过量的稀盐酸,氢氧化钙与稀盐酸反应生成氯化钙和水,将过量的氢氧化钙转化为氯化钙,故填:将滤液中的氢氧化钙完全转化为氯化钙;
(4)步骤⑤由液体得到固体,故该方法是蒸发结晶;
在蒸发过程中,玻璃棒的作用是:搅拌,防止局部温度过高,造成液滴飞溅。

 阅读快车系列答案
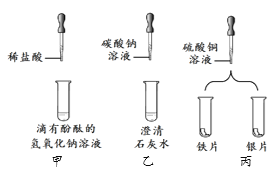
阅读快车系列答案【题目】实验课上,同学们发现一瓶久置的氢氧化钠固体的瓶口有白色粉末。在老师指导下,同学们对该白色粉末的成分进行了探究。
(猜想与假设)猜想Ⅰ:白色粉末是碳酸钠
猜想Ⅱ:白色粉末是氢氧化钠
猜想Ⅲ:白色粉末是__________________________________。
(查阅资料)CaCl2溶液,Ca(NO3)2溶液呈中性。
(实验探究)取白色粉末溶于水形成溶液A,设计如下实验:

(1)由上述实验可知,猜想_______肯定不成立,沉淀C的化学式__________________。
(2)操作①产生气体的化学反应方程式是:_______________________________________。
(3)操作③的X溶液不能用以下的_______________(填字母序号)。
A CaCl2溶液 B Ca(OH)2溶液 C Ba(OH)2溶液 D Ca(NO3)2溶液
(4)操作④的名称___________________________。
(5)请写出操作⑤的实验如下:
方案 | 现象 | 结论 |
方案一:吸取少量溶液D滴入白色点滴板的孔穴中,再滴加无色酚酞试液 | _______________________ | 猜想Ⅰ成立 |
方案二:在洁净的玻璃片上放一片pH试纸,用 _____________________________滴在pH试纸上,将试纸显示的颜色与标准比色卡比较,读出pH。 | pH>7 | 猜想____成立 |
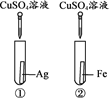
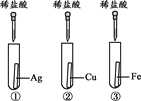
【题目】为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案。
方案A | 方案B |
|
|
(1)能验证三种金属活动性顺序的方案是________(填“A”或“B”)。
(2)方案B中,证明铁的活动性比铜强的现象是___________。