题目内容
6. 海洋是巨大的资源宝库,海洋资源的开发前景十分广阔.
海洋是巨大的资源宝库,海洋资源的开发前景十分广阔.(1)海水“晒盐”的方法主要为“盐田法”(也称“太阳能蒸发法”),这是一种古老而至今仍广泛沿用的方法.海水“晒盐”是利用蒸发结晶 的方法使NaCl晶体析出(填“蒸发结晶”或“降温结晶”)
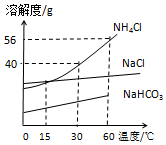
(2)我国化学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,制取纯碱.反应原理如下:步骤一:NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl 步骤二:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$X+H2O+CO2↑,部分物质的溶解度曲线如图所示,请回答:
①步骤二中X的化学式为Na2CO3 ②步骤一中析出晶体后剩余的溶液中含有的溶质是NaHCO3、NH4Cl(写化学式)
(3)30℃时向盛有70g NH4Cl饱和溶液的烧杯中加入10g NH4Cl固体充分搅拌后将溶液升温到60℃,所得溶液中溶质与溶剂的质量比为14:25 (填最简整数比)
(4)等质量的NH4Cl、NaCl饱和溶液分别从30℃时降温至15℃,析出晶体后,所得溶液的溶质质量分数前者=后者(填“>”、“<”、“=”之一)
分析 从溶液中结晶的方法有两种:蒸发结晶和降温结晶,物质的溶解度受温度变化影响较小时,应该用蒸发结晶;物质的溶解度受温度变化影响较大时,应该用降温结晶;
碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
饱和溶液溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%.
解答 解:(1)氯化钠溶解度受温度变化影响较小,因此海水“晒盐”是利用蒸发结晶 的方法使NaCl晶体析出.
故填:蒸发结晶.
(2)由2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$X+H2O+CO2↑可知,反应前钠原子是2个,反应后应该是2个,包含在X中,反应前后氢原子都是2个,反应前碳原子是2个,反应后应该是2个,其中1个包含在X中,反应前氧原子是6个,反应后应该是6个,其中3个包含在X中,因此步骤二中X的化学式为Na2CO3;
步骤一中析出晶体后的溶液是碳酸氢钠的饱和溶液,因此剩余的溶液中含有的溶质是NaHCO3、NH4Cl.
故填:Na2CO3;NaHCO3、NH4Cl.
(3)70gNH4Cl饱和溶液中氯化铵质量为:70g×$\frac{40g}{100g+40g}$×100%=20g,水的质量为:70g-20g=50g,60℃时氯化铵溶解度是56g,因此50g水中最多溶解28g氯化铵,加入10gNH4Cl固体充分搅拌后将溶液升温到60℃,只能够溶解8g氯化铵,因此所得溶液中溶质与溶剂的质量比为:28g:50g=14:25.
故填:14:25.
(4)等质量的NH4Cl、NaCl饱和溶液分别从30℃时降温至15℃时,都仍然是饱和溶液,并且此时两种物质溶解度相等,析出晶体后,所得溶液的溶质质量分数前者=后者.
故填:=.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

 小学教材全测系列答案
小学教材全测系列答案| A. | 空气 | B. | 水银 | C. | 24K金 | D. | 冰水混合物 |
 如图为甲、乙两种物质的溶解度曲线.下列说法正确的是( )
如图为甲、乙两种物质的溶解度曲线.下列说法正确的是( )| A. | 20℃时,甲、乙两种物质的溶解度相同 | |
| B. | 40℃时,l00g乙的饱和溶液中含有60g乙 | |
| C. | 同温时,饱和溶液的溶质质量分数:乙>甲 | |
| D. | 甲中混有少量乙,可采用降温结晶提纯 |
【猜想假设】
猜想(1):该溶液没有变质,为NaOH溶液.
猜想(2):该溶液全部变质,为Na2CO3溶液.
猜想(3):该溶液部分变质,为NaOH和Na2CO3的混合溶液.
【查阅资料】Na2CO3溶液呈碱性
【设计方案】请你完善下表几组同学探讨的设计方案
| 实验操作 | 可能出现的现象与结论 | 同学评价 | |
| 第1组 |  | 若溶液变红,则猜想(2)不成立 | 第2组同学认为:此方案结论不正确,理由是:碳酸钠的水溶液呈碱性,也能使酚酞试液变红. |
| 第2组 |  | 若产生白色沉淀,反应方程式是:CaCl2+Na2CO3═CaCO3↓+2NaCl 则猜想(1)不成立. | 第3组同学认为:此方案还不能确定猜想(2)还是猜想(3)成立. |
| 第3组 |  | 若滤液不变红,则猜想(2)成立;若滤液变红,则猜想(3)成立. | 第1组同学认为:不需过滤也能达到实验目的,更简单的操作方法是:将试管内物质静置,向上层清液加入酚酞试液 |
【结论与反思】NaOH溶液易与空气中二氧化碳反应而变质,为防止变质,所以保存时要密封保存.
(1)第二组实验中,产生沉淀的方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl.
| 品 名 | ×××× |
| 配 料 | 鸡蛋、面粉、白砂糖、柠檬汁、植物油 |
| 保质期 | 90天 |
| 生产日期 | 标于包装上 |
(2)配料中除白砂糖外,主要含有糖类物质的还有面粉.糖类物质是人体所需能量的主要来源;它在人体分解、氧化释放出能量的过程,是将化学能转化为热能.
(3)白砂糖的主要化学成份是蔗糖(C12H22O11),蔗糖的组成中碳、氧元素的质量的最简整数比为72:11.
(4)柠檬汁中富含维生素C,缺乏维生素C会引起坏血病.
(5)各配料中的主要营养物质都属于有机物(选填“无机物”或“有机物”).
| 选项 | 物质(括号内为杂质) | 除杂方法 |
| A | Cu(CuO) | 加入适量的稀盐酸,过滤、洗涤、干燥 |
| B | KCl(MnO2) | 加水溶解、过滤、洗涤、干燥 |
| C | CO2(CO) | 点燃 |
| D | BaCl2溶液(HCl) | 加入过量的氢氧化钡溶液 |
| A. | A | B. | B | C. | C | D. | D |