题目内容
13.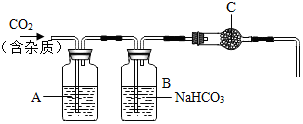 在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为CaCO3,还有少量的硫化物.刘亮同学用这种大理石和稀盐酸反应制取二氧化碳.因为考虑有硫化钙,刘亮还查阅了相关的资料,开展了深入的探究.
在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为CaCO3,还有少量的硫化物.刘亮同学用这种大理石和稀盐酸反应制取二氧化碳.因为考虑有硫化钙,刘亮还查阅了相关的资料,开展了深入的探究.资料一:已知碳酸钙与盐酸的复分解反应可自发进行.在常温下,测得浓度均为a%的下列四种溶液的pH大小情况;
| 溶质 | H2SO4 | HCl | H2S | HClO |
| pH | 小→大 | |||
请你参与探究并完成相关问题.
(1)上表中pH大小情况揭示出复分解反应的一条规律:较强酸发生类似反应可以生成较弱酸.在该探究中发生了如下三个反应,其中不符合上述规律的是C (填字母)
A.HCl+NaHCO3═NaCl+H2O+CO2↑
B.2HCl+CaS═CaCl2+H2S↑
C.H2S+CuSO4═H2SO4+CuS↓
(2)根据以上信息,为了得到干燥、纯净的二氧化碳,设计了如图装置,请你分析:已知B装置的作用是除去HCl气体.A装置中可以放硫酸铜溶液,是为了检验并除去其中的H2S,从而确定大理石中是否含有硫化钙.
分析 (1)根据题意:较强酸发生类似反应可以生成较弱酸分析解答;
(2)利用“2HCl+CaS=CaCl2+H2S↑;H2S+CuSO4=H2SO4+CuS↓”考虑,进行分析.
解答 解:(1)由题目中的表格信息可知:酸性强的酸能制取酸性弱的酸,
| 溶质 | H2SO4 | HCl | H2S | H2CO3 |
| pH | 小→大 | |||
B、HCl的酸性比H2S强,故可发生;
C、因H2S的酸性比硫酸酸性弱,故C错误.
(2)已知B装置的作用是除去HCl气体.因为“2HCl+CaS=CaCl2+H2S↑;H2S+CuSO4=H2SO4+CuS↓”,则A装置中可以放硫酸铜溶液,是为了检验并除去其中的 H2S,从而确定大理石中是否含有硫化钙.
故答案是:
(1)C;(2)硫酸铜溶液,H2S.
点评 本题很好的将化学实验与其他化学知识有机结合,能综合考查学生的能力和素质,分析装置的作用是解答问题的关键要素.

练习册系列答案
相关题目
4.实验室可用高锰酸钾、过氧化氢制取氧气,下列说法错误的是( )
| A. | 两个反应都是分解反应 | B. | 二氧化锰在两个反应中都作催化剂 | ||
| C. | 两个反应的条件不同 | D. | 用H2O2制取氧气更方便 |
2.在盛满空气的密闭容器中燃烧后会使瓶内压强明显降低的物质是( )
| A. | 木炭 | B. | 硫粉 | C. | 蜡烛 | D. | 红磷 |

