题目内容
3. 钙是维持人体正常功能所必需的元素,如图所示为某种补钙剂“钙尔奇”说明书的一部分,取一片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应),烧杯内物质质量变为11.34g,试计算钙尔奇中碳酸钙的质量分数.
钙是维持人体正常功能所必需的元素,如图所示为某种补钙剂“钙尔奇”说明书的一部分,取一片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应),烧杯内物质质量变为11.34g,试计算钙尔奇中碳酸钙的质量分数.
分析 欲正确解答本题,须根据盐酸与碳酸钙反应的化学方程式,得出各物质之间的质量比,列出比例式,即可求出每片钙尔奇中含碳酸钙的质量;再求钙尔奇中碳酸钙的质量分数.
解答 解:设每片钙尔奇中CaCO3的质量为x.
根据题意,完全反应后产生的二氧化碳的质量为:2g+10g-11.34g=0.66g.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.66g
则$\frac{100}{44}=\frac{x}{0.66g}$,解得x=1.5g.
故钙尔奇中碳酸钙的质量分数为:$\frac{1.5g}{2g}×100%=75%$.
故答案为:75%.
点评 本题主要考查学生运用化学方程式进行计算的能力.学生需认真分析已知条件中的数量关系,正确书写化学方程式,才能解答.

练习册系列答案
相关题目
13. 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示.下列说法不正确的是( )
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示.下列说法不正确的是( )
 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示.下列说法不正确的是( )
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示.下列说法不正确的是( )| A. | b点溶液中溶质没有AgNO3 | |
| B. | c点溶液中溶质为Zn(NO3)2 | |
| C. | 若取b~c段固体,滴加稀盐酸,无气泡产生 | |
| D. | d点的固体有2种 |
11.化学改变世界的途径是使物质发生化学变化,下列属于化学变化的是( )
| A. | 将石油分离制得汽油 | B. | 用聚乙烯塑料制得食品袋 | ||
| C. | 工业上分离空气制取氧气、氮气 | D. | 煤焦化产生焦炭、煤焦油等 |
18.如图是氨气燃烧的微观示意图,下列有关说法不正确的是( )
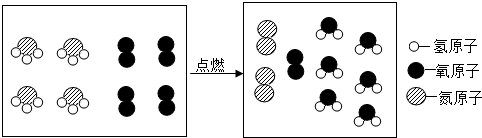

| A. | 该反应是置换反应 | |
| B. | 反应前后原子种类和数目都不变 | |
| C. | 参加反应的两种物质的分子个数比为1:1 | |
| D. | 氨气中氮元素的化合价为-3 |
8.下列物质中混有的杂质,所选的试剂及操作方法均正确的是( )
| 物质 | 杂质 | 选用的试剂及操作方法 | |
| A | CaCO3固体 | Na2CO3固体 | 加适量水,搅拌、过滤、洗涤 |
| B | CO2 | CO | 通入氧气点燃 |
| C | KCl溶液 | K2CO3 | 加入适量硝酸钙溶液,充分反应后过滤 |
| D | NH3 | 水蒸气 | 通入盛浓硫酸的洗气瓶中 |
15.下列各组稀溶液中,利用组内物质的相互反应,就能将各种物质鉴别出来的是( )
| A. | Na2CO3、H2SO4、HCl | B. | KCl、MgCl2、AgNO3 | ||
| C. | Na2SO4、BaCl2、KNO3 | D. | NaOH、NaCl、FeCl3 |
12. 们是人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用,结合图中信息,下列叙述不正确的是( )
们是人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用,结合图中信息,下列叙述不正确的是( )
 们是人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用,结合图中信息,下列叙述不正确的是( )
们是人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用,结合图中信息,下列叙述不正确的是( )| A. | 锰原子核内有25个质子,一个锰原子的质量是54.94g | |
| B. | 锰原子核外有4个电子层,核电荷数为25 | |
| C. | MnO2属于氧化物,在H2O2分解制O2的实验中做催化剂 | |
| D. | KMnO4为紫黑色固体,可用来制备氧气 |
13.菱铁矿的主要成分是FeCO3.下列说法正确的是( )
| A. | FeCO3 中Fe、C、O元素的质量比是1:1:3 | |
| B. | FeCO3中Fe、C、O的原子个数比是56:12:48 | |
| C. | FeCO3中Fe元素的质量分数是$\frac{56}{56+12+16}$×100% | |
| D. | FeCO3的相对分子质量是56+12+16×3 |
