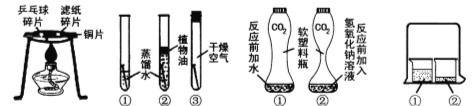
题目内容
【题目】某兴趣小组的同学们整理了一些无明显现象的化学反应,如①二氧化碳与水反应;②二氧化碳与氢氧化钠反应;③盐酸与氢氧化钠反应。
提示:碳酸钠溶液显碱性。
(实验探究)为了证明这些化学反应的发生同学们设计了如下方案:
组别 | I | II | Ⅲ |
实验操作 |
|
|
|
实验现象 | _______ | 无色酚酞溶液变红 | 溶液由红色变为无色 |
实验结论 | 证明CO2可与H2O反应 | 证明CO2可与NaOH反应 | 证明盐酸可与NaOH反应 |
(得出结论)同学们—致认为,只有III组的方案设计是合理的,写出其反应的化学方程式______________。在①②③的三个反应中,属于复分解反应的是________________(填序号)。
(评价反思)(1)I组设计的方案不严谨,请你说明理由__________________。
(2)同学们对II组的设计方案进行改进,都能充分证明CO2可与NaOH发生了化学反应。
改进实验方案 | 实验现象 |
[方案1]取二氧化碳通入氢氧化钠溶液后的液体少许于试管中,滴加足量的_______________ | _________- |
[方案2]分别向两个收集满CO2气体的等体积的软塑料瓶中加入约1/3体积的水和NaOH溶液,立即旋紧瓶,振荡 | __________(填“左”或“右”) 瓶变瘪的程度更大。 |
(归纳总结)同学们总结得出:证明无明显现象的化学反应发生的方法有:①_____________;②______________。
【答案】紫色石蕊试液变红 NaOH +HCl == NaCl + H2O ③ 盐酸挥发的氯化氢溶于水,使紫色石蕊试液变红 稀盐酸 产生气泡 右 证明反应物的减少 证明生成物的生成
【解析】
[实验探究]酸性溶液能使紫色石蕊试液变红,将二氧化碳通入紫色石蕊试液,试液变红,说明二氧化碳和水反应生成了碳酸;
[得出结论] 碱性溶液能使酚酞试液变红,第III组的方案设计是合理的,滴加盐酸过程中酚酞试液由红色变成无色,说明盐酸和氢氧化钠能反应,反应方程式为:NaOH +HCl == NaCl + H2O,是由两种物质相互交换成分生成两种新的化合物的复分解反应;
[评价反思] (1)I组设计的方案不严谨,理由是二氧化碳常用石灰石和和稀盐酸反应制取,盐酸有挥发性,可能是挥发的氯化氢溶于水,使紫色石蕊试液变红;
(2)[方案1]取二氧化碳通入氢氧化钠溶液后的液体少许于试管中,滴加足量的盐酸,有气泡产生,说明二氧化碳和氢氧化钠反应了,因为二氧化碳和氢氧化钠反应生成碳酸钠和水,碳酸钠和盐酸反应生成二氧化碳,产生气泡,而氢氧化钠和盐酸反应无明显现象;
[方案2]分别向两个收集满CO2气体的等体积的软塑料瓶中加入约1/3体积的水和NaOH溶液,立即旋紧瓶,振荡,右边倒入氢氧化钠溶液的瓶变瘪的程度更大。
[归纳总结]由上述实验总结得出:证明无明显现象的化学反应发生的方法有:①证明反应物的减少;②证明生成物的生成。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案