题目内容
6.质量守恒定律是化学反应中的重要规律,我能运用此规律解答下列问题:(1)化学反应前后肯定没有变化的是B(填字母序号)
A.①④⑥B.①③⑤⑥C.①②⑥D.②③⑤
①原子数目②分子数目③元素种类④物质种类⑤原子种类⑥物质的总质量
(2)某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2=2CO2+3H2O(反应条件已略去),则X的化学式为C2H6O
(3)在催化剂并加热的条件下,A与B反应生成C和D.反应前后分子变化的微观示意图如下所示:
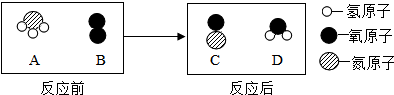
①下列说法正确的是cd(填序号).
a、该反应类型为化合反应
b、4种物质中只有D属于氧化物
c、反应前后,氮元素化合价升高
d、化学反应中分子可以再分,而原子不能
②该反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(4)镁条在空气中完全燃烧后生成氧化镁(只考虑氧气参加反应,下同),若固体质量变化用图1表示,则m2与m1的差表示参加反应的氧气的质量.
(5)实验过程中,镁条点燃后实验现象如图2所示,镁条完全燃烧后,称量得知石棉网上留下固体质量反而比反应前镁条还轻,其原因可能是部分生成物散逸到空气中.

分析 (1)化学反应前后,元素的种类不变,原子的种类、总个数不变;
(2)根据反应前后原子的种类和数目都不变进行解答;
(3)首先要对模型图进行观察,分析物质的微观构成、物质的类别,再找出物质之间的微粒数目关系,写出反应的方程式,然后再对题中各问加以分析解答;
(4)镁和氧气反应生成氧化镁;
(5)根据实验现象可以判断相关方面的问题.
解答 解:(1)反应前后原子数目不变,元素种类不变,原子种类不变,物质的总质量不变;
反应前后分子数目可能改变,也可能不变,物质种类一定改变.
故填:B.
(2)根据反应前后原子的种类和数目都不变:X+3O2═2CO2+3H2O,可以知道反应后有2个C,6个H,7个O,而反应前只出现了6个O,故X中含有2个C,6个H,1个O,故化学式为C2H6O;
(3)由微观示意图可得,化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
a、根据置换反应是指一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,故a错误;
b、根据氧化物是指由两种元素组成,其中一种为氧元素的化合物,可知b错误;
c、反应前,氮元素显-3价,反应后,氮元素显+2价,故c正确;
d、化学反应中分子可以再分,而原子不能再分,故d正确;
故选cd;
故填:①cd;②4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)镁燃烧的化学方程式为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,若固体质量变化用图1表示,则m2与m1之差表示参加反应的氧气的质量.
故填:参加反应的氧气.
(5)通过观察可知,镁燃烧时,一部分生成的氧化镁扩散到了空气中,会导致石棉网上留下固体质量反而比反应前镁条还轻.
故填:部分生成物散逸到空气中.
点评 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.

| A. |  拉瓦锡研究空气成分实验 | B. |  检验氧气 | ||
| C. |  燃烧条件探究实验 | D. |  活性炭净水 |
| A. | 木炭燃烧:原子重新组合成分子,有新的元素生成 | |
| B. | 液氧转化为氧气:分子总数增加 | |
| C. | 食物腐败:分子发生变化 | |
| D. | 光合作用:分子分成原子,有新的原子生成 |
请填写表格空缺
| 名称 | 干冰 | 氯化镁 | 氧气 | 铁 |
| 化学式 | CO2 | MgCl2 | O2 | Fe |
| 构成微粒符号 | CO2 | Mg2+、Cl- | O2 | Fe |
| A. | O4与O3都属于氧化物 | B. | O4与O2、O3都属于单质 | ||
| C. | O4分子是由氧元素组成的 | D. | 合成O4的变化属于物理变化 |
| A. | 澄清的工业废液可直接排放 | |
| B. | 废气塑料制品可进行回收再利用 | |
| C. | 用甲烷(CH4)做燃料,对环境不会造成任何影响 | |
| D. | CO2能与H2O反应生成碳酸(H2CO3),CO2是形成酸雨的有害气体 |
