题目内容
【题目】在密闭容器内进行某化学反应,测量反应前(to)、反应中(t1)、反应后(t2)三个时刻甲、乙、丙、丁四种物质的质量分数,得到质量分数分布图如下。
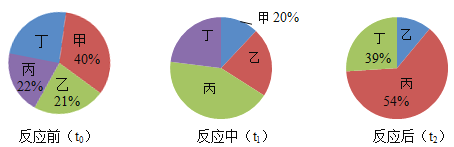
下列说法错误的是
A.该反应中,乙是反应物,丁是生成物
B.t1时刻,甲和丁的质量比为5:7
C.乙、丙的相对分子质量之比为7:16
D.若反应前物质总质量为100g,如果再增加20g甲,则甲与乙可恰好完全反应
【答案】C
【解析】
假设反应前物质的总质量是100g,将题目中的各数据转化为表格,并通过质量比可以计算得到未知数据,如下表:
甲 | 乙 | 丙 | 丁 | |
反应前(to) | 40 | 21 | 22 | 17 |
反应中(t1) | 20 | 14 | 38 | 28 |
反应后(t2) | 0 | 7 | 54 | 39 |
根据以上分析可知:
A、该反应中,乙在反应前后质量减少是反应物,丁在反应前后质量增加是生成物,故A正确;
B、t1时刻,甲和丁的质量比=20:28=5:7,故B正确;
C、题中没提供各物质反应的计量数的信息,不能确定乙、丙的相对分子质量之比为7:16,故C错误;
D、t2时乙剩下7g,甲、乙参加反应的质量比为20:7,再增加20g甲,则甲和乙恰好可以完全反应,故D正确。故选C。

【题目】下列图像一定能正确反映其对应关系的是
|
|
|
|
A红磷在装有空气的密闭集气瓶中燃烧 | B一定里的炭在密闭容器中与足量的氧气充分反应 | C向两份完全相同的稀盐酸中分别加入过量的锌粉、镁粉 | D加热一定质里的氯酸钾与二氧化锰的混合物 |
A.AB.BC.CD.D
【题目】“黄铜”即铜锌合金,古代称为“俞石”。由于外观酷似黄金,常被不法商贩冒充黄金出售。某实验小组为了辨别真伪,用该合金与稀盐酸反应,将三次实验所得相关的数据记录如下:
物质质量 | 第1次 | 第2次 | 第3次 |
所取合金的质量/g | 25 | 25 | 50 |
所用稀盐酸的质量/g | 120 | 160 | 100 |
充分反应后,剩余物总质量/g | 144.6 | 184.6 | 149.6 |
(1)根据上表数据分析,合金中的锌与稀盐酸恰好完全反应时,所取合金与稀盐酸的质量比为___________________,生成气体的质量为_________________;
(2)计算铜锌合金中的铜的质量分数_________;
(3)计算恰好完全反应后所得溶液中溶质的质量分数______(结果保留一位小数)。
【题目】某研究性小组在实验室中模拟炼铁化学原理的实验。

I.定性探究
在一定温度下,该小组同学用一氧化碳还原纯净的氧化铁(实验装置如图),从环保角度看,该小组设计的实验装置有不足之处,你认为该如何改进?_____,观察到玻璃管内固体由红色全部变为黑色。
小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家分头查阅资料。
(查阅资料)
(1)一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
(2)一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
(3)
性质 | 四氧化三铁 | 氧化亚铁 | 铁粉 |
颜色 | 黑色 | 黑色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 能 |
(实验与猜想)
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体全部能被吸引,则该黑色固体中不可能含有_____。
(2)进行猜想:黑色固体可能
a.全部为铁 b._____ c._____
Ⅱ.定量探究
取上述研磨后的黑色固体20g,设计如下实验:

(1)小明同学的猜想_____(填“是”或“否”)成立。
(2)通过计算,确定20g黑色固体的成分及质量_____(请写出计算过程)。
(继续实验)
若要从以上探究所得FeSO4、CuSO4的混合溶液中回收铜和硫酸亚铁晶体,可设计如下实验方案:

(1)步骤①中,金属X是_____;
(2)步骤②中,加入过量稀硫酸的目的是_____。发生反应的化学方程式为_____。