题目内容
(10分)完成下列变化的化学方程式,并按要求填空。
(1)双氧水在二氧化锰催化下的反应:
▲ ;其基本反应类型是 ▲ 。
(2)生石灰作干燥剂的反应:
▲ ;它是 ▲ (选填“吸热”或“放热”)反应。
(3)“湿法冶铜”的反应:
▲ ;其基本反应类型是 ▲ 。
(4)中和反应(试举一例):
▲ ;其基本反应类型是 ▲ 。
(5)金属镁着火不能用二氧化碳扑救,因为镁可以在二氧化碳中继续燃烧生成氧化镁和单质: ▲ 。
【答案】
(1)2H2O2 2H2O+O2↑ 分解
(2) CaO+H2O==== Ca(OH)2 放热
(3) Fe+CuSO4====Cu+FeSO4 置换
(4)HCl+NaOH====NaCl+H2O复分解
 (5)
2Mg+CO2
2MgO+C
(5)
2Mg+CO2
2MgO+C
【解析】略

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
小军见到一种“化学爆竹”(见下图),只要用手拍打锡纸袋,掷在地上,锡纸袋随后就会突然爆开并伴随响声.他认为,这是锡纸袋中的物质发生化学反应生成气体造成的,于是想探究锡纸袋中的物质成分.

[提出问题]锡纸袋中的物质是什么?
[查阅资料]主要内容如下.
①过氧化氢分解生成氧气,化学方程式为 .
②活泼金属与酸反应生成氢气,例如镁与稀硫酸反应生成氢气,化学方程式为 .
③含有碳酸根或碳酸氢根的盐与酸反应生成二氧化碳.
[猜想与验证]小军打开一个未用过的锡纸袋,内有一小包无色液体和一些白色固体.
(l)猜想:无色液体为酸.
验证:在两支试管中分别加入2mL水和该无色液体,各滴加3滴紫色石蕊试液.紫色石蕊试液遇水不变色,遇该无色液体变红.
实验的初步结论:无色液体为酸.
小军取两支试管进行实验的目的是 .
(2)猜想:白色固体为含有碳酸根或碳酸氢根的盐.
验证:请你运用初中所学知识,帮助小军完成下列实验报告.
小军为进一步验证自己的初步结论,继续查找资料,得到下表.
根据上表数据,该白色固体的检验方法是 .
[反思]通过该探究实验,你还想学习的知识是 .

[提出问题]锡纸袋中的物质是什么?
[查阅资料]主要内容如下.
①过氧化氢分解生成氧气,化学方程式为
②活泼金属与酸反应生成氢气,例如镁与稀硫酸反应生成氢气,化学方程式为
③含有碳酸根或碳酸氢根的盐与酸反应生成二氧化碳.
[猜想与验证]小军打开一个未用过的锡纸袋,内有一小包无色液体和一些白色固体.
(l)猜想:无色液体为酸.
验证:在两支试管中分别加入2mL水和该无色液体,各滴加3滴紫色石蕊试液.紫色石蕊试液遇水不变色,遇该无色液体变红.
实验的初步结论:无色液体为酸.
小军取两支试管进行实验的目的是
(2)猜想:白色固体为含有碳酸根或碳酸氢根的盐.
验证:请你运用初中所学知识,帮助小军完成下列实验报告.
| 主要实验装置 | 主要操作步骤 | 主要实验现象 | 实验操作目的 |
 |
在瓶中加入少量白色 固体,再加入适量水,振荡,静置. |
白色固体溶解. | 验证白色固体是否可溶. |
| ①在分液漏斗中加入_______.塞上胶塞,打开活塞,放出适量溶液后,关闭活塞. ②_____________. |
①有大量气体产生. ②_____________ |
验证生成气体的成分. | |
| 实验初步结论:白色固体是可溶性碳酸盐,可能为碳酸钠或碳酸氢钠. | |||
| 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| 溶解度 | ||||
| 盐 | ||||
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
[反思]通过该探究实验,你还想学习的知识是
兴化地处里下河地区,河港纵横,水系发达.但河水中含有较多的碳酸氢钙[Ca(HCO3)2],水的硬度较大.(查阅资料:碳酸氢钙易溶于水.当溶有碳酸氢钙的水遇热时,溶解在水里的碳酸氢钙就会发生分解,生成碳酸钙沉积下来,这就形成了水垢Ca(HCO3)2△CaCO3↓+H2O+CO2↑).已知碳酸氢钠、碳酸氢钾、碳酸氢镁等物质均能在加热条件下发生类似的反应.而碳酸钠、碳酸钾则在通常情况下比较稳定,加热不分解.
请你根据上述信息完成下列各题:
(1)根据上述信息可知,水垢的主要成分是 .你能用什么方法来除去水垢?(用化学方程式表示) .
(2)若碳酸镁粉末中混有少量的碳酸氢镁,请写出除去杂质碳酸氢镁的方法(用化学方程式表示) .
(3)实验室有两包质量均为10.6g的固体,分别是碳酸钠和碳酸氢钠.现分别经如下处理:①充分加热 ②滴加足量的稀盐酸 ③将两步反应生成的气体全部收集后通入足量的澄清石灰水.则生成沉淀的质量 (填“相等”、“不相等”或“无法判断”).
(4)在加热条件下密闭容器内发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得数据如下:
请回答下列问题:
①上表中的”待测数据”的数值是 .
②此密闭容器内反应类型属于 (填基本反应类型).
③若X是水,Q是能使澄清石灰水变浑浊的气体,且X、Y、Z、Q四种物质的化学计量数之比为1:1:2:1,则物质Y的相对分子质量为 .
(5)实验室制取二氧化碳时若不慎使用了浓盐酸,生成的气体中除混有水蒸气外还可能混有 气体,这是因为浓盐酸具有 性.
现要除去杂质气体,可采用如图所示的装置把不纯的气体进行洗气.
①不纯气体应从 (填“a”或“b”)端通入.
②若只需要把生成的气体干燥,可在瓶中盛放 .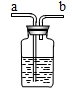
③可在瓶中盛放饱和的碳酸氢钠溶液除去另一种杂质气体.写出有关反应的化学方程式 .
请你根据上述信息完成下列各题:
(1)根据上述信息可知,水垢的主要成分是
(2)若碳酸镁粉末中混有少量的碳酸氢镁,请写出除去杂质碳酸氢镁的方法(用化学方程式表示)
(3)实验室有两包质量均为10.6g的固体,分别是碳酸钠和碳酸氢钠.现分别经如下处理:①充分加热 ②滴加足量的稀盐酸 ③将两步反应生成的气体全部收集后通入足量的澄清石灰水.则生成沉淀的质量
(4)在加热条件下密闭容器内发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得数据如下:
| 物质 | X | Y | Z | Q |
| 反应前质量(g) | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量(g) | 43.6 | 待测数据 | 4.2 | 8.8 |
①上表中的”待测数据”的数值是
②此密闭容器内反应类型属于
③若X是水,Q是能使澄清石灰水变浑浊的气体,且X、Y、Z、Q四种物质的化学计量数之比为1:1:2:1,则物质Y的相对分子质量为
(5)实验室制取二氧化碳时若不慎使用了浓盐酸,生成的气体中除混有水蒸气外还可能混有
现要除去杂质气体,可采用如图所示的装置把不纯的气体进行洗气.
①不纯气体应从
②若只需要把生成的气体干燥,可在瓶中盛放

③可在瓶中盛放饱和的碳酸氢钠溶液除去另一种杂质气体.写出有关反应的化学方程式
兴化地处里下河地区,河港纵横,水系发达.但河水中含有较多的碳酸氢钙[Ca(HCO3)2],水的硬度较大.(查阅资料:碳酸氢钙易溶于水.当溶有碳酸氢钙的水遇热时,溶解在水里的碳酸氢钙就会发生分解,生成碳酸钙沉积下来,这就形成了水垢Ca(HCO3)2△CaCO3↓+H2O+CO2↑).已知碳酸氢钠、碳酸氢钾、碳酸氢镁等物质均能在加热条件下发生类似的反应.而碳酸钠、碳酸钾则在通常情况下比较稳定,加热不分解.
请你根据上述信息完成下列各题:
(1)根据上述信息可知,水垢的主要成分是________.你能用什么方法来除去水垢?(用化学方程式表示)________.
(2)若碳酸镁粉末中混有少量的碳酸氢镁,请写出除去杂质碳酸氢镁的方法(用化学方程式表示)________.
(3)实验室有两包质量均为10.6g的固体,分别是碳酸钠和碳酸氢钠.现分别经如下处理:①充分加热 ②滴加足量的稀盐酸 ③将两步反应生成的气体全部收集后通入足量的澄清石灰水.则生成沉淀的质量________(填“相等”、“不相等”或“无法判断”).
(4)在加热条件下密闭容器内发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得数据如下:
| 物质 | X | Y | Z | Q |
| 反应前质量(g) | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量(g) | 43.6 | 待测数据 | 4.2 | 8.8 |
①上表中的”待测数据”的数值是________.
②此密闭容器内反应类型属于________(填基本反应类型).
③若X是水,Q是能使澄清石灰水变浑浊的气体,且X、Y、Z、Q四种物质的化学计量数之比为1:1:2:1,则物质Y的相对分子质量为________.
(5)实验室制取二氧化碳时若不慎使用了浓盐酸,生成的气体中除混有水蒸气外还可能混有________气体,这是因为浓盐酸具有________性.
现要除去杂质气体,可采用如图所示的装置把不纯的气体进行洗气.
①不纯气体应从________(填“a”或“b”)端通入.
②若只需要把生成的气体干燥,可在瓶中盛放________.
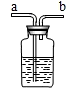
③可在瓶中盛放饱和的碳酸氢钠溶液除去另一种杂质气体.写出有关反应的化学方程式________.

 上,并把试纸显示的颜色与标准比色卡比较,得出pH=10.3,他判断这瓶试剂是碱性溶液。你认为下列对阿里木的操作方法、测量结果及实验结论
上,并把试纸显示的颜色与标准比色卡比较,得出pH=10.3,他判断这瓶试剂是碱性溶液。你认为下列对阿里木的操作方法、测量结果及实验结论 的评价中,正确的是________(填字母)。友情提示:表中“?”表示正确;“?”表示错误。
的评价中,正确的是________(填字母)。友情提示:表中“?”表示正确;“?”表示错误。



