题目内容
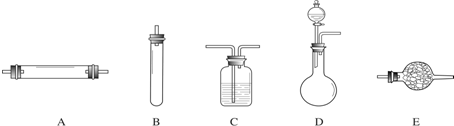
14.请根据图提供的实验装置,回答有关问题.
(1)写出图中标有①、②的仪器名称:①试管;②集气瓶.
(2)制取气体时都必须进行的一项操作是检查装置的气密性.
(3)实验室利用过氧化氢溶液制取氧气,发生反应的化学反应式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,所用制氧气的发生装置为B,排空气法的收集装置为C.
(4)A实验结束,(用排水法收集)应先把导管移出水面_,防止水槽中的水倒流使试管破裂.
(5)已知硫化氢气体可由硫铁矿(固体)和稀硫酸(液体)反应,在常温下制得.该气体易溶于水,相同条件下,密度比空气大.由上述信息推知实验室制取硫化氢可选用的发生装置是B,选用的收集装置是C.
分析 (1)由仪器的用途及图去分析;
(2)为防止制取过程中产生的气体因装置漏气,而收集不到气体,导致浪费药品,所以在装药品前要检查装置的气密性;
(3)从过氧化氢溶液在二氧化锰催化作用下生成水和氧气,由于反应物是固体和液体且不需加热,由于氧气的密度比空气大去分析;
(4)从用排水法收集时,实验结束,要先把导管移出水面,如果先停止加热,随着试管温度的降低,试管内气体的体积越来越小,压强也越来越小,外部气压大于试管内气压,在大外部大气压的作用下,水槽内的水倒吸到试管内,引起试管温度骤然降低,导致试管炸裂去分析;
(5)从硫化氢气体固体和液体反应,在常温下制得;硫化氢气体易溶于水,相同条件下,密度比空气大去分析.
解答 解:(1)由仪器的用途及图可知①为试管,②为集气瓶;故答案为:试管 集气瓶;
(2)为防止制取过程中产生的气体因装置漏气,而收集不到气体,导致浪费药品,所以在装药品前要检查装置的气密性;故答案为:检查装置的气密性;
(3)过氧化氢溶液在二氧化锰催化作用下生成水和氧气,二氧化锰在反应前后质量和化学性质都没有改变,只是加快了过氧化氢反应生成氧气的速率,故二氧化锰是催化剂,所以二氧化锰就应该作为反应条件写在等号的上方,故化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,由于反应物是固体和液体且不需加热,故发生装置应为B,由于氧气的密度比空气大,所以可以用向上排空气法收集;故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ B C;
(4)用排水法收集时,实验结束,要先把导管移出水面,如果先停止加热,随着试管温度的降低,试管内气体的体积越来越小,压强也越来越小,外部气压大于试管内气压,在大外部大气压的作用下,水槽内的水倒吸到试管内,引起试管温度骤然降低,导致试管炸裂.故答案为:把导管移出水面;
(5)硫化氢气体固体和液体反应,在常温下制得;故发生装置可选B;硫化氢气体易溶于水,所以不能用排水法收集,相同条件下,密度比空气大,所以可以用向上排空气法收集;故答案为:B C.
点评 实验室制取气体时,发生装置的选择取决于反应物的状态和反应条件;收集装置的选择取决于水溶性和气体的密度;考查了实验室制取氧气的反应原理,及注意事项,是考试的重点也是中考的重点.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| 物 质 | 选用的方法或试剂 | |
| A | 二氧化碳和氮气 | 燃着的木条 |
| B | 二氧化锰和木炭 | 看颜色 |
| C | 氧气和二氧化碳 | 通入澄清石灰水 |
| D | 硬水和软水 | 加入肥皂水 |
| A. |  倾倒液体 | B. |  过滤 | C. |  给液体加热 | D. |  检查装置气密性 |
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 制取蒸馏水时,应先向烧瓶内加入几片碎瓷片 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| D. | 向试管中滴加液体时,胶头滴管不能伸入试管中 |
| A. | 加热升华,升华温度300℃ | |
| B. | 在一般情况下较稳定,但在高温下可能会分解放出氰化物 | |
| C. | 溶于热水,微溶于冷水,极微溶于热乙醇 | |
| D. | 三聚氰胺性状为纯白色单斜棱晶体,无味 |
 某同学在一次玩耍中,偶然发现竹子浸没水中后,在竹子上打一小洞,会看到水中有很多小气泡冒出.
某同学在一次玩耍中,偶然发现竹子浸没水中后,在竹子上打一小洞,会看到水中有很多小气泡冒出. 已知,A、B、C、D四种物质之间存在以下转化关系.其中C是单质,D是相对分子质量最小的氧化物
已知,A、B、C、D四种物质之间存在以下转化关系.其中C是单质,D是相对分子质量最小的氧化物