题目内容
9.如图中,a是纯净气体,b是黑色粉末为氧化铜或炭粉或氧化铜与炭粉的混合物.根据实验装置回答下列问题.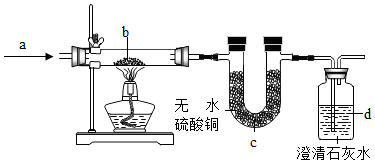
(1)若a为二氧化碳气体,在C处无变化,d的出口有可燃性气体导出,则b中反应的化学方程式是C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO.
(2)若b中黑色粉末为氧化铜,实验中黑色粉末变为红色,C处无变化,则a为一氧化碳,d中的现象为澄清的石灰水变浑浊.
(3)若C中的白色物质变为黑色,d中出现浑浊,则a为氢气,黑色粉末为氧化铜和碳.
分析 (1)根据实验现象:c处的硫酸铜无变化,d处的气体燃烧,而a为二氧化碳,因此b处是碳,碳和二氧化碳反应产生一氧化碳;
(2)根据无水硫酸铜无现象,说明没有水的产生;甲中黑色粉末变红,可知A为还原性的气体一氧化碳;
(3)根据c中无水硫酸铜变蓝,d中出现白色浑浊,说明产物有水和二氧化碳,可知A为氢气,黑色粉末为氧化铜和碳.
解答 解:(1)由实验现象:c处的硫酸铜无变化,d处的气体燃烧,而a为二氧化碳,可知b处是碳,碳和二氧化碳反应产生一氧化碳,反应的方程式为:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO;
故答案为:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO;
(2)b中黑色粉末为氧化铜,实验中黑色粉末变为红色,c处无变化,说明没有水的产生,因此a为还原性的气体一氧化碳,一氧化碳和氧化铜反应产生铜和二氧化碳,二氧化碳能够使澄清的石灰水变浑浊;
故答案为:一氧化碳;澄清的石灰水变浑浊;
(3)c中无水硫酸铜变蓝,d中出现白色浑浊,说明产物有水和二氧化碳,可知a为氢气,黑色粉末为氧化铜和碳;
故答案为:氢气;氧化铜和碳.
点评 本题考查了常见物质的推断,完成此题,可以依据题干提供的信息结合物质的性质进行分析.

练习册系列答案
相关题目
17.为了测定硫酸铜晶体(CuSO4•XH2O)中结晶水的含量,做如表试验,将硫酸铜晶体放在坩埚里加热,至不含结晶水得数据:回答问题.
(1)反应生成水的质量为9克
(2)硫酸铜晶体中结晶水的含量的百分比为36%
(3)在CuSO4•xH2O中,x=5
(4)若实验过程中出现下列情况对X的值有何影响?(填“偏大”“偏小”“无影响”)
①加热过程中有少量CuSO4粉末溅出偏大;
②加热后,坩埚放置在空气中冷却称重偏小.
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | 测得晶体中结晶水个数 |
| 20.5g | 45.5g | 36.5g |
(2)硫酸铜晶体中结晶水的含量的百分比为36%
(3)在CuSO4•xH2O中,x=5
(4)若实验过程中出现下列情况对X的值有何影响?(填“偏大”“偏小”“无影响”)
①加热过程中有少量CuSO4粉末溅出偏大;
②加热后,坩埚放置在空气中冷却称重偏小.
14.有关原子的相对质量说法正确的是( )
| A. | 相对原子质量的单位是g | |
| B. | 相对原子质量就是原子的质量 | |
| C. | 相对原子质量是以一种碳原子的质量的$\frac{1}{12}$为标准,其它原子的质量跟它比较所得的比 | |
| D. | 原子质量是相对原子质量的简称 |
18.某同学欲探究一包Ca(OH)2的白色粉末是否完全变质.
(1)猜想与假设:该包Ca(OH)2白色粉末未完全变质.
(2)收集证据:Ca(OH)2在空气中会与空气中的二氧化碳发生反应,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(3)实验探究:
结论:该Ca(OH)2的白色粉末已经部分变质.
(1)猜想与假设:该包Ca(OH)2白色粉末未完全变质.
(2)收集证据:Ca(OH)2在空气中会与空气中的二氧化碳发生反应,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(3)实验探究:
| 实验步骤 | 实验现象 | 实验结论 |
| 样品中有氢氧化钙存在 | ||
| 样品中有碳酸钙存在 |

 2013年我国西南地区遭遇持续干旱,造成人畜饮水困难,各地采取措施积极抗旱.用你学过的化学知识回答下列问题:
2013年我国西南地区遭遇持续干旱,造成人畜饮水困难,各地采取措施积极抗旱.用你学过的化学知识回答下列问题: