题目内容
20.如下粒子结构示意图得出的结论中,正确的是( )
| A. | ①④属于同种元素 | B. | ②③④属于离子 | ||
| C. | ⑤易失去电子成为阴离子 | D. | ①⑤的结构稳定 |
分析 A、根据不同种元素最本质的区别是质子数不同,元素的种类由质子数决定,进行解答;
B、根据当核电荷数=质子数=核外电子数,为原子;当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;进行解答;
C、根据原子结构示意图的特点:稀有气体元素,原子最外层电子数为8(氦为2 );金属元素的最外层电子数一般少于4,易失去最外层电子形成阳离子;非金属元素的最外层电子数一般多于4,易得到电子,形成阴离子;
D、根据原子结构示意图的特点,进行解答.
解答 解:A、根据不同种元素最本质的区别是质子数不同,元素的种类由 质子数决定,可知①④中的质子数相同,因此属于同种元素;故A正确;
B、根据当核电荷数=质子数=核外电子数,为原子;故②为原子;当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;可知③中核电荷数=质子数=11>核外电子数10,为阳离子;④中核电荷数=质子数=9<核外电子数=10,为阴离子;故B错误;
C、根据原子结构示意图的特点:稀有气体元素,原子最外层电子数为8(氦为2 );金属元素的最外层电子数一般少于4,易失去最外层电子形成阳离子;非金属元素的最外层电子数一般多于4,易得到电子,形成阴离子;粒子结构示意图由可知⑤属于金属元素,易失去最外层电子形成阳离子;故C错误;
D、根据原子结构示意图的特点,①易得到电子,形成阴离子,⑤易失去最外层电子形成阳离子,因此说结构不稳定;故D说法错误;
故选A
点评 本题考查学生对元素的种类由质子数决定的理解,根据核电荷数,质子数,核外电子数的关系进行判断微粒的种类,及根据原子结构示意图的特点判别元素的种类的进行解题能力.

练习册系列答案
相关题目
10.下列描述属于氧气化学性质的是( )
| A. | 常温下是无色气体 | B. | 氧化性 | ||
| C. | 不易溶于水 | D. | 密度比空气稍大 |
11.小敏做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,看到有气泡产生.是不是拿错了药品?小敏经检验确认没有拿错药品,而是氢氧化钠溶液变质了.

【分析】氢氧化钠溶液变质的方程式是:2NaOH+CO2=Na2CO3+H2O.
【提出问题】该氢氧化钠溶液是全部变质还是部分变质?
【查询资料】l.已知反应:BaCl2+Na2CO3═2NaCl+BaCO3↓
Ⅱ.部分盐溶液的pH如表:
【设计实验】小敏依据查询的资料设计实验步骤,请你帮她补充完整.
【实验结论】通过实验,小敏检验出该氢氧化钠溶液只是部分变质.
【进一步实验】小敏用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验.她设计如图所示的实验方案.
(1)写出步骤①发生反应的化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(2)步骤①中滴加适量溶液A后的操作是过滤.
(3)步骤③判断盐酸与氢氧化钠恰好完全反应的实验现象是溶液刚好由红色变成无色.

【分析】氢氧化钠溶液变质的方程式是:2NaOH+CO2=Na2CO3+H2O.
【提出问题】该氢氧化钠溶液是全部变质还是部分变质?
【查询资料】l.已知反应:BaCl2+Na2CO3═2NaCl+BaCO3↓
Ⅱ.部分盐溶液的pH如表:
| 盐溶液 | NaCl | Na2C03 | BaCl |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加足量的氯化钡溶液,并不断振荡. | 有白色沉淀生成 | 说明原来溶液中一定含有的溶质是碳酸钠. |
| (2)向步骤(1)充分反应后的溶液中滴加酚酞试液. | 溶液变成红色 | 说明原来溶液中还一定含有氢氧化钠. |
【进一步实验】小敏用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验.她设计如图所示的实验方案.
(1)写出步骤①发生反应的化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(2)步骤①中滴加适量溶液A后的操作是过滤.
(3)步骤③判断盐酸与氢氧化钠恰好完全反应的实验现象是溶液刚好由红色变成无色.
9.关于催化剂的说法正确的是( )
| A. | 催化剂在化学反应前后质量和性质都不变 | |
| B. | 催化剂只能加快反应速率 | |
| C. | 催化剂只能减慢反应速率 | |
| D. | 如果没有二氧化锰作催化剂,氯酸钾加热也不会分解 |
 哈尔滨老鼎丰食品有限公司(糕点厂)始建于1911年,是黑龙江省食品行业骨干企业.“老鼎丰”品牌是黑龙江省著名商标.目前,糕点已发展形成上千品种,五十余个系列品牌,形成了配方独到、工艺独特,色、香、味、形俱佳,自成一派的“哈式”体系,具有很强的地域代表性.请回答下列问题:
哈尔滨老鼎丰食品有限公司(糕点厂)始建于1911年,是黑龙江省食品行业骨干企业.“老鼎丰”品牌是黑龙江省著名商标.目前,糕点已发展形成上千品种,五十余个系列品牌,形成了配方独到、工艺独特,色、香、味、形俱佳,自成一派的“哈式”体系,具有很强的地域代表性.请回答下列问题: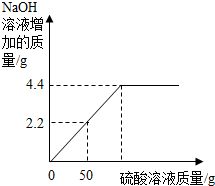 菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究.取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,加入硫酸溶液的质量与NaOH溶液增加的质量变化关系记录如下图(菱镁矿中的杂质不溶于水,不与酸发生反应),求
菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究.取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,加入硫酸溶液的质量与NaOH溶液增加的质量变化关系记录如下图(菱镁矿中的杂质不溶于水,不与酸发生反应),求