题目内容
京京同学对金属活动性顺序等知识进行了研究。
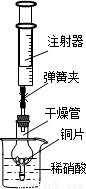
(1)根据下图中的实验现象判断,稀盐酸里的A 、B 、C 、D 四种金属中,在金属活动性顺序里,位于氢后面的金属是(填字母)

(2)将甲、乙两种金属片分别放入硫酸铜溶液中,乙表面析出红色固体,甲没有明显现象。判断甲、乙、铜三种金属的活动性由强到弱的顺序为
(3)查阅资料:金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原。在下列① ②中各写一个化学方程式,③中写出还原金属氧化物的方法。

(4)查阅资料:在金属活动性顺序里,位于氢后面的金属Cu ,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:
3Cu + 8HNO3(稀)= 3Cu(NO3)2+ 2NO↑+4H2O
反应生成的NO是无色、难溶于水的气体,在常温下与空气中的O2迅速化合生成NO2 , NO2是红棕色、有刺激性气味的有毒气体。
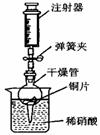
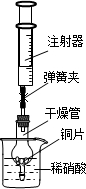
用下图所示实验装置进行实验,可以证明铜与稀硝酸反应生成的气体是NO。

① 检查装置的气密性:关闭弹簧夹,将干燥管放入带有水的烧杯中,若观察到 则表明该装置的气密性良好。
② 按上图所示进行实验:打开弹簧夹,用注射器慢慢抽取干燥管内的气体,稀硝酸沿着干燥管慢慢上升,直到 停止抽拉注射器,关闭弹簧夹,观察干燥管内的现象: 反应停止后,打开弹簧夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的气体推出),关闭弹簧夹后取下注射器,并抽取一定量的空气,观察到气体变为红棕色。
③ 上述实验完成后,用足量NaOH 溶液将气体吸收,其目的是
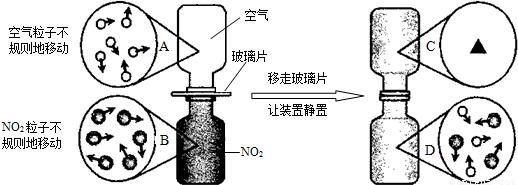
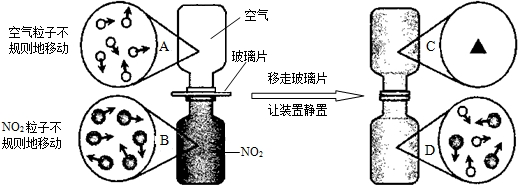
④ 下图是NO2气体和空气混合的实验示意图,观察图中A 、B 、D 的表示方法,在C 处画出相应的气体组成的粒子示意图。

⑤ 在3. 84g Cu 中加入100g 稀HNO3 溶液,如恰好完全反应,计算生成NO的质量(化学方程式见上)和反应前稀HNO3 溶液中溶质的质量分数。
(请写出计算过程)
(1) D
(2)乙>Cu >甲
(3)① 2HgO![]() 2Hg+O2↑
2Hg+O2↑
② C+2CuO![]() 2Cu+CO2↑
2Cu+CO2↑
③ 用一种金属还原金属氧化物
(4)① 若干燥管内的液(水)面比烧杯内的液(水)面低,且过一段时间后干燥管内的液(水)面保持不变
② 充满干燥管 铜片表面有气泡产生,铜片溶解,溶液由无色变成蓝色,液面下降
③ 防止污染空气
④

⑤
解:设生成NO的质量为x,稀硝酸中溶质的质量为y
3Cu + 8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
3×64 8×63 2×30
3.84 y x
![]()
![]()
![]()
![]()
![]()
答:生成NO的质量为1.2g,稀硝酸中溶质的质量分数为10.08%



 (京京同学对金属活动性顺序等知识进行了研究.
(京京同学对金属活动性顺序等知识进行了研究.