题目内容
1.如图,下列说法错误的是( )| A. |  一定质量的溶液稀释时加入水质量与溶质质量的变化 | |
| B. |  t1℃时,A、B两物质的饱和溶液的溶质质量相等 | |
| C. | 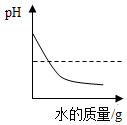 向NaOH溶液中加盐酸时,溶液PH的变化 | |
| D. | 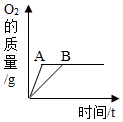 用AB两份等质量等浓度的双氧水制取氧气,A中加入了二氧化锰 |
分析 A.溶液由溶质与溶剂组成,稀释是增加溶剂的质量,与溶质的质量无关.
B.根据溶解度交点的意义来分析.
C.根据酸碱中和反应中pH的变化来分析;
D.根据加入二氧化锰做催化剂只改变反应速率而不能增加氧气的质量进行解答.
解答 解:A.加水稀释,溶剂质量增加,对溶质质量没有影响,因此溶液中溶质质量不变,故正确;
B.该交点的意义是,在t1℃时,AB两种物质的溶解度相等,该温度下,等质量的饱和溶液中所含溶质质量相等,此选项中没有指明同质量,故错误;
C.氢氧化钠溶液加稀盐酸,pH逐渐降低,恰好反应时pH等于7,继续加稀盐酸,pH小于7,故正确;
D.加入二氧化锰做催化剂只改变反应速率而不能增加氧气的质量,应该生成氧气质量相同,故正确.
故选B.
点评 正确辨别坐标所表示的变化量,是解答此类问题的关键,分析变化中相关量的变化关系,是解答问题的基础.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
9.如图是汽车尾气中有毒气体转变为无毒气体的微观示意图,图中不同的圆球代表不同原子.下列说法错误的是( )


| A. | 该反应中有4种分子 | |
| B. | 该反应属于置换反应 | |
| C. | 该反应遵循质量守恒定律 | |
| D. | 参加反应的两种分子的个数比为1:1 |
6.一种新型绿色电池--燃料电池,是把是把H2、CO、CH4气体和空气不断输入直接氧化,使化学能转变为电能,它被称为21世纪的绿色发电站,这三种气体可以作为燃料电池所需燃料的原因是( )
| A. | 都是无毒、无害气体 | B. | 燃烧产物均为二氧化碳和水 | ||
| C. | 都可以燃烧并放出大量的热 | D. | 均在自然界都大量存在 |
2.“过氧化钠(Na2O2)”是一种淡黄色固体,能与水或二氧化碳反应放出氧气.实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分及其质量.
【提出问题】变质的过氧化钠粉末中有哪些成分,它们的质量是多少?
【查阅资料】
①2Na2O2+2H2O═4NaOH+O2↑ 2Na2O2+2CO2═2Na2CO3+O2
②碳酸钠溶液显碱性,氯化钙溶液显中性.
【猜想与假设】
(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是Na2O2和Na2CO3的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物
…
【设计实施方案】
【解释与结论】同学们经过认真分析,得出了以下结论.
粉末中含有的成分及质量
【反思与评价】
(1)实验室在保存过氧化钠时应注意密封保存.
(2)有同学提出把第②步实验中足量的石灰水改为足量氯化钙溶液,至沉淀不再生成时过滤,向滤液中滴加无色酚酞试液,若液体变红,则证明原粉末中有NaOH.你认为该方案是否合理并说明理由不合理,因为过氧化钠与水反应能生成氢氧化钠,不能判断原来是否存在氢氧化钠..
【提出问题】变质的过氧化钠粉末中有哪些成分,它们的质量是多少?
【查阅资料】
①2Na2O2+2H2O═4NaOH+O2↑ 2Na2O2+2CO2═2Na2CO3+O2
②碳酸钠溶液显碱性,氯化钙溶液显中性.
【猜想与假设】
(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是Na2O2和Na2CO3的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物
…
【设计实施方案】
| 实验步骤 | 实验现象 |
| ①取3.00g变质粉末于一支大试管内,加入适量的水,共收集到0.32g气体,然后用带火星木条检验生成的气体. | 固体完全溶解,带火星木条复燃, 不用填 |
| ②继续向上述试管中加入足量的石灰水,充分反应. | 有白色沉淀生成 |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体1.00g. |
粉末中含有的成分及质量
| Na2O2 | NaOH | Na2CO3 | |
| 成分(填“有”或“没有”) | |||
| 质量(g) |
(1)实验室在保存过氧化钠时应注意密封保存.
(2)有同学提出把第②步实验中足量的石灰水改为足量氯化钙溶液,至沉淀不再生成时过滤,向滤液中滴加无色酚酞试液,若液体变红,则证明原粉末中有NaOH.你认为该方案是否合理并说明理由不合理,因为过氧化钠与水反应能生成氢氧化钠,不能判断原来是否存在氢氧化钠..

 化学活动课上,老师给同学们表演了一个“水能生火”的魔术(如图所示),他将包有过氧化钠(Na2O2)粉末的脱脂棉放在石棉网上,向脱脂棉上滴了几滴水,脱脂棉立刻燃烧起来.通过查阅资料可知,过氧化钠和水反应的产物只有两种,都是初中化学常见的物质.根据所学化学知识回答:
化学活动课上,老师给同学们表演了一个“水能生火”的魔术(如图所示),他将包有过氧化钠(Na2O2)粉末的脱脂棉放在石棉网上,向脱脂棉上滴了几滴水,脱脂棉立刻燃烧起来.通过查阅资料可知,过氧化钠和水反应的产物只有两种,都是初中化学常见的物质.根据所学化学知识回答: ”和“
”和“ ”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
