题目内容
【题目】三种固体物质a、b、c的溶解度曲线如图所示,下列说法正确的是( )

A.a、b、c三种物质的饱和溶液从t2℃降温到t1℃时都有晶体析出
B.t1℃时三种物质的饱和溶液中溶质的质量分数大小为b>a>c
C.t2℃时,将50g a物质加入到100g水中完全溶解形成饱和溶液
D.a中混有少量b时可采取蒸发溶剂的方法提纯得到a
【答案】C
【解析】
A、a、b两种物质的溶解度随温度的升高而增加,故将a、b两种物质的饱和溶液从t2℃降温到t1℃时有晶体析出,c物质的溶解度随温度的升高而降低,将c物质的饱和溶液,t2℃降温到t1℃时,c物质变为不饱和溶液,不会有晶体析出,不符合题意;
B、t1℃时,a、c的溶解度曲线相交,说明在t1℃时a、c的溶解度相同,故t1℃时a、c饱和溶液的溶质质量分数相等,t1℃时,b的溶解度大于a、c,t1℃时b的饱和溶液的溶质质量分数大于a、c饱和溶液的溶质质量分数,则t1℃时三种物质的饱和溶液中溶质的质量分数大小为b>a=c,不符合题意;
C、t2℃时,a物质的溶解度为50g,故t2℃时,将50g a物质加入到100g水中完全溶解形成饱和溶液,符合题意;
D、a物质的溶解度受温度变化影响较大,所以a中混有少量b时可采取降温结晶的方法提纯得到a,不符合题意。
故选C。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
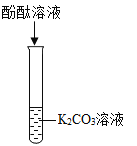
轻松课堂标准练系列答案【题目】碳酸钾是农家肥草木灰的主要成分,兴趣小组对碳酸钾的化学性质探究如下。
(比照实验)小组同学根据碳酸钠的化学性质设计了如下实验。
实验 | Ⅰ | Ⅱ | Ⅲ |
步骤 |
|
|
|
现象 | 无色溶液变红色 | 左边试管中有气泡产生右边澄清石灰水变浑浊 | 产生白色沉淀 |
(继续探究)
实验Ⅳ:向实验Ⅰ反应后的溶液中滴加过量的硝酸钡溶液,可观察到的现象为_______________。
(实验梳理)
根据上述实验总结碳酸钾的化学性质(除实验Ⅰ外都用化学反应方程式表达。
实验Ⅰ_______________;
实验Ⅱ________________;
实验Ⅲ________________;
实验Ⅳ_______________。
(交流讨论)
(6)完善钠的原子结构示意图,应在横线上方填写的数字为_____________。

(7)通过上面的四个实验不难发现,碳酸钾与碳酸钠的的化学性质很是相似。其原因在于_______________。
(知识拓展)
(8)下列说法正确的是_________________。
A草木灰可用来改良酸性土壤结构
B所有可溶性盐溶液的pH=7
CCO32-也能使无色的酚酞试液变红
D草木灰可与尿素混合施用
【题目】如表列出了部分元素原子结构示意图。下列叙述错误的是( )
Na | Al | Si | P | S | Cl | Ar | |
|
|
|
|
|
|
|
|
A. 在显电性的情况下,表中m的值为8
B. 如果失去第三层电子,上表空格内的微粒符号可表示为Mg+2
C. 上表中所列元素属于同一周期的原因是原子核外的电子层数相同
D. 钠原子在化学反应中易失电子
【题目】我校化学兴趣小组的同学在学习盐的化学性质时,做了如下实验:向一定量的NaHCO3溶液中加入一定量的稀HCl,反应的化学方程式是:![]() ,待完全反应后(假设反应产生的气体全部逸出),对反应后溶液的溶质成分进行如下探究。请完成猜想,并根据问题填空:
,待完全反应后(假设反应产生的气体全部逸出),对反应后溶液的溶质成分进行如下探究。请完成猜想,并根据问题填空:
(假设与猜想)
猜想1:_____ 猜想2:NaCl、NaHCO3 猜想3:NaCl、HCl 猜想4:NaCl、NaHCO3、HCl
同学们经过讨论一致认为猜想4不成立,原因是 _____。
(实验探究)
实验用品 | pH试纸、镁片、稀盐酸、AgNO3溶液、氧化铜粉末、石蕊溶液 | ||
实验方案 | 实验操作 | 实验现象 | 实验结论 |
(1) | 取反应后溶液,加入稀盐酸 | 无气泡产生 | 猜想_____不成立 |
(2) | 取反应后溶液,滴在pH试纸上 | 试纸变色,对照比色卡,pH<7 | 猜想3成立 |
(3) | 取反应后溶液,加入氧化铜粉末 | 固体溶解,溶液由无色变为蓝色 | 猜想3成立,写出该反应的化学方程式:_____ |
(4) | 取反应后溶液,滴加AgNO3溶液 | 产生白色沉淀 | 猜想3成立 |
(得出结论)猜想3正确。
(评价与反思)老师对同学们的探究过程给予了肯定,同时指出探究中存在着一处明显的错误,原因是_____。
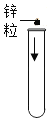
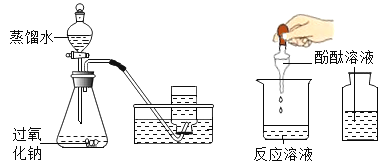
【题目】小红同学进行酸碱中和反应的实验(如下图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂。为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中液体颜色没有变化。于是她对烧杯中的溶液进行了以下探究:

(1)小红认为此时烧杯中的溶液可能有以下三种情况:①盐酸与氢氧化钠恰好完全反应;②氢氧化钠有剩余;③盐酸有剩余。小明同学却判定不可能“氢氧化钠有剩余”,他的理由是__________。
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写下表:
实验方法 | 可能观察到的现象 | 结论 |
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中 | ____________ | 盐酸过量 |
无明显现象 | 盐酸与氢氧化钠恰好完全反应 |
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的,你认为其中不正确的是___________(填序号)。
A生锈的铁钉 B碳酸钠粉末 C硫酸钠粉末 D氢氧化铜
(4)下列曲线能够表示小红所做实验中溶液pH变化趋势的是____________(填序号)。

(5)小红在完成实验的过程中看到有气泡冒出,你猜测的原因是__________。为证实自己的猜想是正确的,小红在向试管中取样后,还需要滴加_______,__________(填两种种类不同的物质名称)。