题目内容
2.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,进行如下实验:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入适量的稀硫酸,溶液立即变蓝;
(1)写出实验①中发生反应的离子方程式ClO-+2I-+2H+=I2+Cl-+H2O.
实验②:取适量实验①后的溶液,滴加4mL 0.5mol•L-1的亚硫酸钠溶液,蓝色恰好完全褪去.
(2)实验②化学反应中转移电子的物质的量是0.004mol.
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是SO42-、I2、ClO-.
(4)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+.据此,将反应2Al+2OH-+2H2O=2AlO2-+3H2↑拆写为两个“半反应式”:氧化反应式:2Al+8OH--6e-=2AlO2-+4H2O,还原反应式:6H2O+6e-=6OH-+3H2↑.
分析 (1)实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原生成氯离子;
(2)实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,根据亚硫酸钠和转移电子的关系式计算转移电子的物质的量;
(3)氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性;
(4)原子得电子,化合价降低元素所在的反应物是氧化剂,原子失电子,化合价升高元素所在的反应物是还原剂.
解答 解:(1)实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原生成氯离子,该反应中,次氯酸根离子得电子作氧化剂,碘离子失电子是还原剂,氧化产物是碘,所以氧化性强弱为:ClO->I2,反应离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O,故答案为:ClO-+2I-+2H+=I2+Cl-+H2O;
(2)实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,氧化剂是碘,还原剂是亚硫酸钠,氧化产物是硫酸根离子,所以氧化性强弱为:I2>SO42-,反应离子方程式为:H2O+I2+SO32-=SO42-+2I-+2H+,
设转移电子的物质的量为x.
H2O+SO32-+I2=SO42-+2I-+2H+转移电子
1mol 2mol
0.5mol/L×0.004L x
$\frac{1mol}{0.5mol/L×0.004L}$=$\frac{2mol}{x}$=0.004mol,
答:转移电子的物质的量是0.004 mol;
(3)反应①:ClO-+2I-+2H+=I2+Cl-+H2O,氧化性强弱为:ClO->I2,反应②:H2O+I2+SO32-=SO42-+2I-+2H+,氧化性强弱为:I2>SO42-,综合以上得出结论:SO42->I2>ClO-,故答案为:SO42-、I2、ClO-;
(4)反应2Al+2OH-+2H2O=2AlO2-+3H2↑中,失电子化合价升高元素是Al元素,发生氧化反应:2Al+8OH--6e-=2AlO2-+4H2O(或Al+4OH--3e-=AlO2-+2H2O),
失电子,化合价降低元素是H元素,发生还原反应,即6H2O+6e-=6OH-+3H2↑(2H2O+2e-=2OH-+2H2↑),
故答案为:2Al+8OH--6e-=2AlO2-+4H2O(或Al+4OH--3e-=AlO2-+2H2O);6H2O+6e-=6OH-+3H2↑(2H2O+2e-=2OH-+2H2↑).
点评 本题以实验设计为载体考查了物质氧化性强弱的判断,明确“同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性”是解本题的关键,难度不大.

| A. | 熔点、沸点 | B. | 可燃性、氧化性 | C. | 密度、硬度 | D. | 颜色、状态 |
| A. | 牛奶 | B. | 过氧化氢溶液 | C. | 纯净水 | D. | 冰水混合物 |
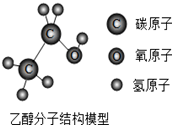
| A. | 乙醇分子是由碳、氢、氧元素组成 | |
| B. | 乙醇是由碳原子、氢原子、氧原子构成 | |
| C. | 乙醇中质子数和电子数的比是1:1 | |
| D. | 每个乙醇分子中都含有8个原子核 |
 如图是空气的成分示意图,请你图示回答下列问题.
如图是空气的成分示意图,请你图示回答下列问题.